Das Prostatakarzinom ist in Deutschland der häufigste bösartige Tumor beim Mann. Wird Prostatakrebs früh erkannt, stehen die Heilungschancen gut. Ein zu früher Beginn einer Therapie bei gering fortgeschrittenem Tumor oder beim älteren Patienten mit niedriger Lebenserwartung könnte jedoch die Lebensqualität unnötig schmälern. Hilfreich für die Entscheidung für oder gegen die Behandlung sind moderne Messmethoden und Klassifikationen.
Aktuelle Schätzungen gehen in Deutschland von 66.900 Neuerkrankungen (Jahr 2016) aus [1]. Das Niedrigrisiko-Prostatakarzinom ist aber oft nicht lebensbedrohend – auch bei konservativer oder verzögerter kurativer Therapie in den ersten zehn Jahren. Da die Nebenwirkungen der Prostatakarzinomtherapie (Inkontinenz und Impotenz) im Alter zunehmen, sollte der Arzt eine unnötig aggressive Behandlung zugunsten der Lebensqualität der Patienten vermeiden. Andererseits könnte er bei zu langem Hinauszögern einer kurativen Therapie das Fenster zur Heilbarkeit der Tumorerkrankung verpassen.
Frühes Prostatakarzinom: Unter- und Übertherapie
Beim frühen Prostatakarzinom können – sofern kein höhergradiger Tumor vorliegt – auch bei zunächst abwartender Therapie (aktive Überwachung: Kontrollbiopsien, rektale Tastuntersuchungen und Kontrollen des prostataspezifischen Antigens PSA [2]) sehr gute mittelfristige Überlebensraten erzielt werden. Demgegenüber ist bei höhergradigen Tumoren unter konservativer Therapie die Mortalität mittelfristig beträchtlich. Auch bei gut bis mäßig differenzierten Tumoren erreicht die prostatakarzinomspezifische Sterblichkeit die 50-Prozent-Marke, wenn die Patienten lang, also 20 – 30 Jahre – überleben [3]. Diese breite Spannweite des biologischen Verhaltens führt häufig zur Über- und Untertherapie. Von einer Früherkennung des Prostatakarzinoms können vor allem Männer mit langer Lebenserwartung profitieren. Je kürzer sie ist, desto größer ist auch das Risiko von Überdiagnose und Übertherapie. Wünschenswert wäre es, klinisch verwertbare Informationen zur Lebenserwartung über das kalendarische Alter hinaus einzusetzen, um die richtige Entscheidung treffen zu können.
Messung der Komorbidität
Die am häufigsten genutzte Komorbiditätsklassifikation ist der Charlson-Score [4]. Er erfasst 19 Begleiterkrankungen, die unterschiedlich gewichtet werden (1, 2, 3, 6 Punkte) und addiert die einzelnen Punkte zu einem Score (Tabelle 1) [4]. Je höher der Score ist, desto unwahrscheinlicher, dass der Patient von einer aggressiven Therapie profitiert. Vorteile dieser Klassifikation sind einfache Anwendbarkeit, relativ wenige erforderliche Informationen (nur wenige Abstufungen nach Schweregrad) und allgemeine Akzeptanz. Der Charlson-Score misst aber z. B. nicht den Allgemeinzustand, den sozioökonomischen Status oder das Rauchen – alles Faktoren, die das Mortalitätsrisiko erhöhen können.
Klinische Szenarien beim frühen Prostatakarzinom
Eine Möglichkeit ist, alle Patienten mit einem neu diagnostizierten frühen Prostatakarzinom zu betrachten. In dieser Gruppe sind jedoch auch sehr kranke Patienten mit kurzer Lebenserwartung zu finden – sie prägen somit stark die Mortalitätsstatistik. Betrachtet man dagegen nur Patienten, die für eine radikale Prostatektomie ausgewählt wurden, so sind diese schwerkranken Patienten schon durch die vorangegangene Selektion ausgeschlossen. Die konkurrierende Sterblichkeit erreicht bei derselben numerischen Komorbidität und demselben Alter bei Patienten, die für eine radikale Prostatektomie ausgewählt wurden, nur die Hälfte des Risikos, das bei unselektionierten Patienten zu erwarten gewesen wäre [5].
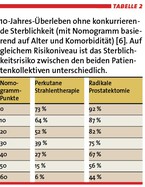
Ähnlich groß sind die Unterschiede – bei gleichem Alter und numerischer Komorbidität – zwischen Patienten, die eine radikale Prostatektomie beziehungsweise eine perkutane Strahlentherapie erhielten (Tabelle 2) [6]. Diese Diskrepanzen machen deutlich, dass es wahrscheinlich nicht sinnvoll ist, alle Therapiekandidaten gemeinsam zu betrachten.
Traditionell wurde eine Lebenserwartung von zehn Jahren oder ein Alter von 70 Jahren als Grenze angesehen, um von einer kurativen Therapie des frühen Prostatakarzinoms zu profitieren [7]. Gesunde Männer haben jedoch auch im Alter von über 70 – 80 Jahren eine Lebenserwartung von mehr als zehn Jahren. Patienten, die mit 75 Jahren oder älter für eine radikale Prostatektomie ausgewählt wurden, hatten in diesem Krankengut eine Zehn-Jahres-Überlebenswahrscheinlichkeit von über 70 % [8]. Bei besonders gesunden Patienten kann diese nahezu 100 % erreichen [8].
In dem Patientengut wurde auch untersucht, wie sich die vorangegangene Selektion auf die prognostische Bedeutung von Begleiterkrankungen bei über 70-jährigen Prostatektomie-Patienten auswirkt. Zunächst zeigte sich, dass drei häufige Begleiterkrankungen – Diabetes mellitus, chronische Lungenerkrankung und Zweittumor – ihre Bedeutung vollständig verloren hatten. Patienten, die diese Begleiterkrankungen aufwiesen, wurden also nur für eine radikale Prostatektomie ausgewählt, wenn diese als geringfügig und prognostisch günstig eingeschätzt wurden. Bei Patienten jenseits des 70. Lebensjahrs waren hingegen eine zerebrale oder periphere Gefäßerkrankung, Rauchen, eine American-Society-of Anesthesiologists-Klasse 3 und das Fehlen eines höheren Bildungsabschlusses (Hochschulabschluss oder Meister) bedeutsam [9]. Bei der Lebenserwartungsabschätzung in dieser besonderen hochselektionierten Patientengruppe sollte der Arzt deshalb besonders diese Faktoren beachten und weniger relevante Begleiterkrankungen zurückstellen. Lag einer der genannten fünf Risikofaktoren vor, entsprach dies in der besagten Stichprobe von über 70-jährigen Prostatektomiepatienten bei Hazard-Ratios zwischen 2,07 und 2,23 und einer Hazard-Ratio für ein Lebensjahr von 1,09 [9] einem Äquivalent von acht bis zehn Lebensjahren. Diese Zahl muss natürlich unter der Voraussetzung betrachtet werden, dass die untersuchten Patienten [9] – mit einer Ausnahme – alle zwischen 70 und 80 Jahre alt waren, die Streubreite der Variable "Alter" also eingeschränkt war.
Empfehlungen für den Hausarzt
Fehlt eine prognostisch bedeutsame Komorbidität, kann auch jenseits des 70. Lebensjahrs eine Prostatakarzinom-Früherkennung sinnvoll sein [10]. Die relativ lange verbleibende Lebenserwartung erhöht die Wahrscheinlichkeit, dass gesunde ältere Männer von einer kurativen Therapie profitieren. Die infrage kommende Population gesunder Senioren sollte deshalb als separate Patientengruppe betrachtet werden.
Bei einer weiteren Auftrennung dieser Patienten entsprechend ihrer Lebenserwartung können – neben den Begleiterkrankungen – auch der Allgemeinzustand, das Rauchverhalten und der Bildungsabschluss wichtige prognostische Informationen liefern.
Bei gesunden, für eine radikale Prostatektomie geeigneten älteren Patienten sollte der Arzt besser unterschiedliche Aspekte des Gesundheitszustands erfassen, statt vorliegende Begleiterkrankungen einfach zu addieren.
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2017; 39 (9) Seite 16-18