Drei Viertel der neu diagnostizierten Brustkrebsformen gelten als hormonabhängige Tumoren. Im letzten Jahr haben wichtige Erkenntnisse über die Therapiedauer und die ovarielle Suppression bei prämenopausalen Patientinnen zu Neuerungen in der adjuvanten Standardtherapie geführt. Bei postmenopausalen Patienten wird die optimale Therapiesequenz Tamoxifen/Aromatasehemmer diskutiert.
Brustkrebs ist die häufigste Krebserkrankung der Frau und gehört bei Frauen zwischen dem 40. und dem 50. Lebensjahr zur Hauptursache der Todesfälle in den westlichen Staaten. 75 % der neu diagnostizierten Brustkrebsformen weisen eine Positivität von Östrogen- und Progesteronrezeptoren auf und gelten somit als hormonabhängige Tumoren. Zielgerichtet gegen den Östrogenrezeptor können diese Tumoren mittels endokriner Therapie systemisch sehr wirksam behandelt werden. Ein großer Teil der Verbesserung der Prognose nach Brustkrebsdiagnose in den letzten Jahren ist der endokrinen Therapie zuzuschreiben. Bislang hat sich bei der adjuvanten endokrinen Therapie im Gegensatz zur palliativen endokrinen Therapie noch keine neuere Substanz als Standardtherapie durchgesetzt. Allerdings haben wichtige Erkenntnisse über die Therapiedauer und die ovarielle Suppression bei prämenopausalen Patientinnen zu Neuerungen in der adjuvanten Standardtherapie geführt.
Prämenopausale Patientinnen
Lange wurden die Ergebnisse der TEXT- und der SOFT-Studie erwartet, welche mehr Aufschluss über die optimale endokrine Therapie bei der prämenopausalen Patientin geben sollten. Die Standardtherapie war bis dahin die fünfjährige endokrine Therapie mit Tamoxifen, sofern die Patientin über die ganze 5-Jahres-Periode prämenopausal war, oder die Umstellung (Switch) auf einen Aromatasehemmer, sofern die Menopause in dieser Zeit eingetreten war [1].
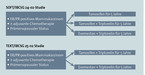
Gute Evidenz für eine zusätzliche ovarielle Suppression bestand noch nicht; diese wurde in der Praxis höchstens für sehr junge Patientinnen oder für solche mit hohem Risiko für einen Rückfall für bis zu 3 Jahre empfohlen. Große Bedenken für die Verabreichung einer ausgedehnten endokrinen Therapie mittels ovarieller Suppression bei prämenopausalen Patientinnen bestehen sowohl wegen starker Nebenwirkungen, welche mitunter die Lebensqualität beeinträchtigen, als auch wegen Langzeitfolgen (Osteoporose, Diabetes, Herz-Kreislauf, kognitive Funktion). Mit der Veröffentlichung der Zwischenergebnisse der SOFT-/TEXT-Studien (Abb. 1) 2014 und 2015 konnten nun mehrere Ungewissheiten geklärt werden [2, 3].
Indikation der ovariellen Suppression
1. Für die Gesamtgruppe aller prämenopausalen Frauen besteht kein Vorteil einer ovariellen Suppression zusätzlich zur Tamoxifen-Therapie (90,7 % vs. 91,3 % fernrezidivfreies 5-Jahres-Überleben), hingegen besteht ein kleiner Vorteil für die Aromatasehemmer-Therapie in Kombination mit ovarieller Suppression (90,7 % vs. 93,0 % fernrezidivfreies Überleben in den Studien).
2. Patientinnen, welche aufgrund der Eigenschaften und des Stadiums ihres Brustkrebses keine adjuvante Chemotherapie verabreicht bekommen und somit als Niedrigrisikogruppe gelten, profitieren nicht von einer ovariellen Suppression. Patientinnen dieser Gruppe wiesen nach 5 Jahren ein fernrezidivfreies Überleben von 98,6 % unter Tamoxifen allein versus 98,7 % unter Tamoxifen in Kombination mit ovarieller Suppression und versus 99,3 % mit ovarieller Suppression kombiniert mit einem Aromatasehemmer auf (statistisch kein signifikanter Unterschied).
3. Patientinnen, welche aufgrund der Tumoreigenschaften oder des Stadiums eine adjuvante Chemotherapie erhalten und danach innerhalb von 8 Monaten noch einen prämenopausalen Hormonstatus aufweisen, profitieren von einer ovariellen Suppression in Kombination mit Tamoxifen oder mit einem Aromatasehemmer (fernrezidivfreies Überleben von 84,8 % bzw. 87,8 % im Vergleich 83,6 % für Tamoxifen allein).
4. Sehr junge Patientinnen (< 35 Jahre) zeigen den größten Nutzen einer ovariellen Suppression, sei es in Kombination mit Tamoxifen (krankheitsfreies 5-Jahres-Überleben bei 79 %) oder noch mehr mit einem Aromatasehemmer (83 %), im Vergleich zu Patientinnen, welche nur Tamoxifen erhalten (68 %).
5. Die Subgruppe der HER2- und östrogenrezeptorpositiven Patientinnen profitiert sehr deutlich von einer ovariellen Suppression gegenüber Tamoxifen (Hazard Ratio von 0,42 [95%-KI: 0,22–0,80]). Allerdings erhielt in den Studien fast die Hälfte der Patientinnen keine HER2-gerichtete Therapie (Trastuzumab), sodass die Ergebnisse mit Vorbehalt zu betrachten sind. Basierend auf den neueren Daten der SOFT- und der TEXT-Studie kann der in Tabelle 1 aufgeführte Algorithmus zur Festlegung der prämenopausalen Patientin vorgeschlagen werden.
Die optimale Therapiedauer
Sowohl in der TEXT- als auch in der SOFT-Studie wurde die endokrine Therapie für eine Dauer von fünf Jahren verabreicht. Die Möglichkeit einer verlängerten Gabe von Tamoxifen für die Dauer von 10 Jahren wurde in zwei groß angelegten Studien gegenüber der Standarddauer von fünf Jahren untersucht [4]. Sowohl in der ATLAS- (n = 15.244) als auch in der ATTOM-Studie (n = 6.953) wurden die Patientinnen nach 5 Jahren abgeschlossener Tamoxifen-Therapie in je einen Studienarm – 5 weitere Jahre Tamoxifen-Gabe oder Stopp der endokrinen Therapie – randomisiert. Dabei wurden prämenopausale sowie postmenopausale Patientinnen eingeschlossen. Beide Studien zeigten eine klare Reduktion der Rezidivrate in der Gruppe mit der Therapieverlängerung, welche auch nach den zehn Jahren Therapie noch anhielt. In der ATLAS-Studie zeigte sich eine Risikoreduktion der Rezidive um 25 % nach 10 Jahren und eine Reduktion der Brustkrebsmortalität um 29 %, unabhängig vom Menopausenstatus.
Ähnlich wie in den alten Studien mit Tamoxifen über 5 Jahre versus kein Tamoxifen bestand auch hier eine Übertragung des Therapieeffektes über die 5-jährige Therapiedauer hinaus betreffend Rezidive und Mortalität. Eine verlängerte Tamoxifen-Gabe über 10 Jahre macht somit besonders für junge (prämenopausale) Patientinnen Sinn. Zusätzlich bestehen bei prämenopausalen Frauen weniger Bedenken betreffend Endometriumkarzinomrisiko unter verlängerter Tamoxifen-Gabe, da bei den jungen Frauen das Risiko niedriger als bei postmenopausalen Patientinnen ist.
Eine verlängerte Tamoxifen-Gabe ist jedoch nicht für Patientinnen sinnvoll, die im Verlauf der endokrinen Therapie postmenopausal werden. Bei diesen Patientinnen (in der Regel > 45-jährig bei Beginn der Tamoxifen-Therapie) ist nach Abschluss der fünfjährigen Tamoxifen-Therapie ein Wechsel auf einen Aromatasehemmer von größerem Nutzen (Abb. 2) [5].
Postmenopausale Patientinnen
Bei der postmenopausalen Patientin sind neben Tamoxifen drei Aromatasehemmer zur endokrinen Therapie des Mammakarzinoms zugelassen: Anastrozol, Exemestan und Letrozol. Eine Aromatasehemmer-Therapie für die Dauer von fünf Jahren zeigt in groß angelegten Studien mit jeweils langem Follow-up eine deutliche Überlegenheit betreffend krankheitsfreiem und fernrezidivfreiem Überleben gegenüber der 5-jährigen Tamoxifen-Therapie. Die Verbesserung des krankheitsfreien Überlebens beträgt rund 20 % unter Aromatasehemmer im Vergleich zur Tamoxifen-Therapie [6 – 8].
Eine Kombination von Tamoxifen mit einem Aromatasehemmer in Sequenz über insgesamt fünf Jahre wurde ebenfalls in mehreren Studien untersucht. Auch hier wurde eine Verbesserung des rezidivfreien Überlebens im Kombinationsarm Tamoxifen (2 bis 3 Jahre), dann Aromatasehemmer (ebenfalls zwei bis drei Jahre), gegenüber der alleinigen Tamoxifen-Therapie gezeigt [9, 10]. Ob eine sequenzielle Tamoxifen/Aromatasehemmer-Therapie der fünfjährigen alleinigen Aromatasehemmer-Behandlung ebenbürtig ist, ist noch nicht sicher.
Die Datenqualität für die Aromatasehemmer-Therapie über fünf Jahre ist deutlich robuster, sodass sicherlich kein therapeutischer Nutzen einer Tamoxifen/Aromatasehemmer-Sequenz besteht. Vergleichbare Daten bestehen für die umgekehrte Sequenz: Aromatasehemmer/Tamoxifen über insgesamt fünf Jahre [7].
Somit sollte eine 5-jährige Aromatasehemmer-Therapie bei der postmenopausalen Patientin empfohlen und angestrebt werden [11]. Beginnt eine Patientin die endokrine Therapie mit einem Aromatasehemmer und bestehen beträchtliche Nebenwirkungen, kann nach zwei bis drei Jahren auf Tamoxifen gewechselt werden, ohne dass ein signifikanter therapeutischer Nachteil resultiert [7, 11]. Befindet sich die Patientin bei Therapiestart noch in der Perimenopause, ist sicherlich die Sequenz einer Tamoxifen/Aromatasehemmer-Therapie anzustreben [5].
Indikationen für eine alleinige Tamoxifen-Behandlung
Eine alleinige Tamoxifen-Therapie bei der postmenopausalen Patientin wird trotz höherem klinischen Nutzen der Aromatasehemmer nicht als obsolet betrachtet [11]. Bei Patientinnen mit niedrigem Risiko für ein Rezidiv aufgrund der Biologie des Karzinoms (z. B. gut differenziert, nodal-negativ, tubuläre Histologie etc.) kann unter Berücksichtigung der unterschiedlichen Nebenwirkungsprofile durchaus auch eine alleinige Tamoxifen-Behandlung als sinnvoll erachtet werden. Zu den prädiktiven Faktoren, welche auf einen besonderen Benefit der Aromatasehemmer-Therapie gegenüber Tamoxifen allein hinweisen, gehören sicherlich die Anzahl befallener Lymphknoten, die hohe Proliferationsrate, das höhere Grading, aber auch die lobuläre Histologie [12].
Eine verlängerte endokrine Therapie nach fünfjähriger Tamoxifen-Therapie kann das Gesamtüberleben auch bei der postmenopausalen Patientin weiter verbessern [4]. Sowohl für die verlängerte Tamoxifen-Gabe für weitere fünf Jahre als auch für einen Wechsel auf Letrozol nach vier bis sechs Jahren Tamoxifen besteht gute Evidenz für den Nutzen einer verlängerten endokrinen adjuvanten Behandlung. Was die Risikoreduktion betrifft, zeigt sich der Vorteil schon relativ früh und ist betreffend Gesamtüberleben potenter als bei der 10-jährigen Tamoxifen-Therapie, wo sich der Nutzen größtenteils nach der 10-jährigen Therapie zeigt. Der Nutzen einer verlängerten endokrinen Therapie nach einer 5-jährigen Aromatasehemmer-Therapie ist nicht bekannt und wird in verschiedenen laufenden Studien untersucht.
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2016; 38 (6) Seite 34-40