Vorhofflimmern (AF) ist die häufigste Form der Arrhythmie und diese Rhythmusstörung wird sich voraussichtlich in den kommenden Dekaden mehr als verdoppeln. Grundstein der Therapie von AF ist die Prophylaxe von thromboembolischen Insulten. Hierzu stehen Vitamin-K-Antagonisten sowie die sogenannten NOAK oder DOAK zur Verfügung. Die kardiologischen Therapieprinzipien von AF bestehen aus reiner Frequenzkontrolle oder einer Rhythmuskontrolle. Für die rhythmuserhaltende Therapie stehen Antiarrhythmika sowie die Katheterablation zur Verfügung. Die pathophysiologischen und vor allem molekularen Erkenntnisse bei Patienten mit AF haben zudem zu neuen Therapieoptionen beigetragen, die unter dem Begriff der Upstream-Therapie zusammengefasst werden.
Vorhofflimmern (AF) ist die häufigste kardiale Arrhythmie und zudem eine der wesentlichen Ursachen für thromboembolische Organinfarkte [10, 33, 3, 25, 27, 18, 12]. Epidemiologische Arbeiten zeigen eindeutig, dass die Rate von Vorhofflimmern mit steigendem Lebensalter exponentiell ansteigt. Aufgrund der demografischen Entwicklung wird sich die Häufigkeit von Patienten mit AF in den nächsten 30 Jahren mehr als verdoppeln [10, 33, 3, 25, 27, 18, 12]. Insgesamt tritt AF bei ca. 5 % aller Menschen ab der 6. Lebensdekade auf, bei den über 80-jährigen Menschen beträgt die Inzidenz nahezu 20 %. Aufgrund der klinisch eingeschränkten Möglichkeit zur pharmakologischen Therapie mit klassischen antiarrhythmischen Substanzen wurde in den letzten zehn Jahren die Katheterablation von AF vorangetrieben und vermehrt auch nicht-ionenkanalblockierende Substanzen zur Behandlung von AF untersucht [12, 35, 31, 14, 22, 21].
Pathophysiologische Untersuchungen zum AF zeigten hierbei, dass AF einen progressiven elektrischen Prozess selbst initiiert, wodurch "Vorhofflimmern weiteres Vorhofflimmern bedingt" [35]. Zudem führt AF zu strukturellen Veränderungen des atrialen Myokards, wodurch eine homogene Erregungsausbreitung innerhalb der Vorhöfe gehemmt und wiederum AF begünstigt wird. Diese zumeist auf interstitieller Fibrose beruhenden Prozesse sind zu einem großen Teil durch eine verstärkte Aktivierung des Angiotensin-II-Systems bedingt. Erste experimentelle Daten konnten eine Überexpression des ACE-Enzyms sowie weiterer intrazellulärer Signalkaskadenkomponenten zeigen [35, 31, 14, 22, 21, 2, 11]. Weitergehende In-vivo-Untersuchungen konnten belegen, dass die Behandlung mit einem Angiotensin-II-hemmenden Pharmakon ein therapeutisches Prinzip darstellt [14]. Die Gabe von z. B. ACE-Hemmern bzw. Angiotensin-II-Rezeptorblockern (Sartane; ARB) wird deshalb als Upstream-Therapie von AF bezeichnet, da sie über die klassische Ionenkanalblockade mit Antiarrhythmika der Klassen I bis IV hinausgeht.
Antikoagulation
Thromben entstehen im Körper, wenn die Faktoren der Virchow-Trias erfüllt sind:- Stase des Blutes
- endotheliale Läsionen und
- gesteigerte Gerinnungsaktivität (Hyperkoagulabilität).
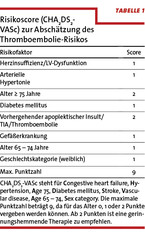
Erreichen diese Komponenten eine gewisse Schwelle, kann es an der Gefäßwand zur Bildung von Thromben kommen. Hierbei entsteht eine komplexe Interaktion von Gewebefaktoren mit Blutplättchen und Gerinnungsfaktoren. Das Risiko, eine thromboembolische Komplikation zu erleiden, ist abhängig von begleitenden kardiovaskulären Risikofaktoren sowie dem Patientenalter. Für Patienten, die ein erhöhtes Risiko aufweisen, welches aktuell nach dem CHA2DS2-VASc-Score eingestuft wird (vgl. Tabelle 1), ist die Einleitung einer oralen Antikoagulation als Dauertherapie die Therapie der Wahl [22].
Thromben entstehen bei Vorhofflimmern zumeist im linken Herzohr. Hieraus wird auch erklärbar, dass systemische Embolien häufig bei VHF auftreten, während aus dem Vorhof stammende Lungenembolien eine Rarität bei Patienten mit VHF zu sein scheinen. Die prothrombogenen Veränderungen der Herzvorhöfe am Endokard bei Vorhofflimmern werden als endokardiales Remodeling zusammengefasst. Pathophysiologisch erscheint das Auftreten von oxidativem Stress ein wesentlicher Mechanismus für die Expression prothrombogener Oberflächenmoleküle am Endokard zu sein. Das endokardiale Remodeling ist wesentlich durch Angiotensin II vermittelt. Diese pathophysiologischen Erkenntnisse zum endokardialen Remodeling können auch erklären, warum begleitende kardiovaskuläre Faktoren wie arterielle Hypertonie, Herzinsuffizienz oder Diabetes mellitus zu einer gesteigerten Häufigkeit von Vorhofthromben führen (Parameter des CHA2DS2-VASc-Scores), denn diese Faktoren beeinflussen selbst den Grad des oxidativen Stresses im Vorhof und somit die Expression der Adhäsionsmoleküle im Endokard. Wichtig ist, dass dieser Teil des endokardialen Remodelings vollkommen unabhängig vom bestehenden Vorhofrhythmus ist.
Zur Prophylaxe thromboembolischer Komplikationen stehen aktuell Marcumar® oder NOAK zur Verfügung. Die Therapie mit ASS ist deutlich ineffektiver und zeigt im Vergleich zu Apixaban ähnlich hohe Blutungsraten. NOAK steht für "neue orale Antikoagulanzien" und umfasst Thrombininhibitoren und Faktor-Xa-Inhibitoren zusammen. Die Begrifflichkeit NOAK ist jedoch längerfristig unglücklich, da die Bezeichnung "neu" nach wenigen Jahren nicht mehr aktuell ist. Aus diesem Grund sollte künftig besser die Kurzform DOAK für direkte orale Antikoagulanzien verwendet werden.
Alle Patienten mit einem Score von ≥2 sollten antikoaguliert werden. Bei einem Score-Wert von 1 ist die Datenlage noch nicht eindeutig, wobei die orale Antikoagulation auch bei diesen Patienten eher positiv gesehen wird.
Umgang mit NOAK
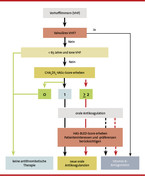
Nachdem die Indikationsstellung der Antikoagulation bei einem Patienten mit AF überprüft wurde, muss festgelegt werden, wie die orale Antikoagulation erfolgen soll. Hierzu kommen Vitamin-K-Antagonisten und NOAK in Betracht. Im Rahmen einer Risiko-Nutzen-Analyse sollte beispielsweise anhand der uns zur Verfügung stehenden Score-Systeme (CHA2DS2-Vasc, HAS-BLED) sowie der Vorgeschichte des Patienten ein Status quo erhoben werden (Abb. 1). Ebenso sollten sowohl die aktuelle Medikation als auch geplante Therapien wie operative Eingriffe berücksichtigt werden.
Vor der Behandlung mit einem NOAK (vgl. Tabelle 2 und 3) ist ein sorgfältiges Informationsgespräch unerlässlich. Themen wie mögliche Komplikationen, Interaktionen mit anderen Substanzen, Zeitpunkt bzw. Intervall der Einnahmen, Verhalten bei Dosierungsfehlern, Wirkdauer etc. sollten detailliert besprochen werden. Der Patient sollte einen entsprechenden Ausweis zur Therapie erhalten (Übersicht 1).
Im Rahmen der Dauertherapie sollten Änderungen von Organfunktionen (Niere, Leber etc.) aufgrund möglicher Wirkverstärkungen bzw. Interaktionen beachtet werden (Übersicht 1 und 2). Die Nierenfunktionsparameter müssen bei allen Patienten einmal im Jahr gemessen werden. Bei eingeschränkter errechneter GFR (< 50 ml/min) sollte diese Messung zwei- bis dreimal pro Jahr erfolgen und ggf. eine Dosisanpassung vorgenommen werden. Eine Dosisreduktion wird für Dabigatran bei Patienten mit einer Kreatinin-Clearance (CrCl) zwischen 30 und 50 ml/min und einem HAS-BLED-Score > 3 generell empfohlen. Keine NOAK sollten bei einer GFR > 30 ml/min angewandt werden. Hierin weichen die AF-Leitlinien von den Fachinformationen der Substanzen ab, die z. T. einen Einsatz bis 15 ml/min erlauben.
Generell ist unter einer Behandlung mit NOAK keine routinemäßige Bestimmung der koagulatorischen Parameter erforderlich. Darüber hinaus wird eine Dosisanpassung unter Berücksichtigung dieser Laborwerte nicht empfohlen.
Im Rahmen eines operativen Eingriffes bzw. einer invasiven Prozedur muss eine zeitweilige Pause der Behandlung mit NOAK erfolgen. Obschon unter der Behandlung mit Vitamin-K-Antagonisten ein Bridging zur Vermeidung thromboembolischer Ereignisse vorgeschlagen wird, benötigt ein Patient unter NOAK unter dem Aspekt des vorhersehbaren Zeitintervalls bis zur Normalisierung der antikoagulatorischen Wirkung lediglich eine entsprechende Pausierung der Medikation vor und nach dem Eingriff. Stehen Eingriffe ohne Blutungsrisiko wie z. B. Katarakt oder Glaukom-Operationen bevor, sollte die Einnahme 12 bzw. 24 h zuvor pausiert werden, abhängig davon, ob die entsprechende Substanz einmalig oder zweimal pro Tag eingenommen werden muss. Bei Eingriffen mit einem niedrigen Blutungsrisiko sollte die Einnahme mindestens 24 Stunden zuvor, bei einem erhöhten Blutungsrisiko mindestens 48 Stunden zuvor pausiert werden. Patienten mit gestörter Nierenfunktion sollten unter Rivaroxaban bei einem niedrigen Blutungsrisiko mindestens 36 Stunden, bei einem erhöhten Blutungsrisiko mindestens 48 Stunden pausieren.
Frequenzkontrolle
Die Therapiestrategie der Frequenzkontrolle ist für viele Patienten mit AF ausreichend. Eine Frequenzkontrolle kommt immer dann in Betracht, wenn der Patient hinsichtlich des AF asymptomatisch ist. Zur Kontrolle der Herzfrequenz sollten Betablocker oder Kalziumantagonisten vom Verapamil-Typ eingesetzt werden. Diese Substanzgruppen begrenzen die Ventrikelfrequenz auch bei körperlicher oder psychischer Belastung. Digitalisglykoside wirken im Gegensatz in diesen Situationen nur bedingt, so dass der frequenzsenkende Effekt von Digitalisglykosiden vor allem in Ruhe auftritt. Die RACE- und RACE-II-Studie konnten zeigen, dass eine Kontrolle der Herzfrequenz auf < 100/min im Tagesmittel in einem Langzeit-EKG wahrscheinlich ausreichend ist. Eine strenge Kontrolle der mittleren Herzfrequenz zeigte keinen Vorteil.
Katheterablation von Vorhofflimmern
Nachdem die ersten Berichte der intraoperativen Therapie von Vorhofflimmern, die die Anlage langer Inzisionen in das Myokard beider Vorhöfe vorsah, beeindruckende Ergebnisse lieferten, wurde diese Strategie mit linearen Läsionen durch "Punkt-für-Punkt"-Ablationen in ein interventionelles Verfahren übertragen [5, 37]. Dabei fiel bei den so behandelten Patienten eine häufige atriale Extrasystolie aus den Ostien der Lungenvenen auf, die als Vorhofflimmer-Trigger identifiziert werden konnten [15]. Die Ausschaltung dieser Trigger durch punktförmige Hochfrequenzstromablation innerhalb der Lungenvenen verhinderte das Wiederauftreten von Vorhofflimmern (sog. Triggerablation) [19].
Nachdem die Bedeutung des linken Vorhofes und triggernder Pulmonalvenen-Foci in den Vordergrund rückte, haben sich eine Reihe von Ablationsstrategien entwickelt, die alle eine Pulmonalvenenisolation (PVI) beinhalten (vgl. Abb. 3), aber je nach Profil des Patienten und dem Charakter des Vorhofflimmerns (z. B. persistierende Form) auch die Behandlung des Vorhofes selbst vorsehen. Zur Durchführung der Katheterablation stehen Hochfrequenzstrom, Kryoenergie oder neuerdings auch Laserballonverfahren zur Verfügung. Der Erfolg der PVI beträgt bei paroxysmalem Vorhofflimmern bis zu 80 %, wobei bei ca. 50 % der Patienten eine zweite Prozedur notwendig wird. Die Erfolgsrate ist bei Patienten mit persistierendem AF oder gar langanhaltendem persistierenden AF deutlich schlechter (ca. 50 %).
Auch nach erfolgreicher PVI sollte entsprechend dem Risikoscore die orale Antikoagulation beibehalten werden, wenn diese primär aufgrund des CHA2DS2-Vasc-Scores indiziert ist. Nur bei Patienten ohne Risikofaktoren für Thromboembolien (Score = 0) kann die Antikoagulation drei Monate nach PVI beendet werden.
Stellenwert der Katheterablation als "First-line-Therapie" des paroxysmalen Vorhofflimmerns
Die aktualisierten Leitlinien eröffnen die Möglichkeit der primären Katheterablation. Welche Daten stehen uns für diese praktisch wichtige Entscheidung zur Verfügung? Zwei Studien zur Effizienz und Sicherheit der Katheterablation als First-line-Therapie wurden im Jahre 2012 publiziert: Nielsen und Mitarbeiter randomisierten 294 Patienten mit paroxysmalem Vorhofflimmern, die noch keiner medikamentösen antiarrhythmischen Therapie unterzogen worden waren, auf eine primäre Katheterablation oder eine medikamentöse Therapie mit Klasse-IC- oder Klasse-III-Substanzen [28]. Vorhofflimmerrezidive wurden 3, 6, 12, 18 und 24 Monate nach Ablation bzw. unter Therapie mittels 7-Tage-Holter registriert. Im kumulativen "AF burden" (Zeit im Vorhofflimmern im Rahmen der Holterregistrierung als Anteil am Nachsorgezeitraum) zeigte sich kein signifikanter Gruppenunterschied (13 %-Ablation vs. 19 % med. Therapie, p=0,1).
Morillo präsentierte eine weitere Studie zur Katheterablation als First-line-Behandlung: In RAAFT 2 erhielten 127 Antiarrhythmika-naive Patienten mit paroxysmalem Vorhofflimmern (87,5 %) und auch persistierendem Vorhofflimmern (12,5 %) eine zeitnahe Ablation oder die Initiierung einer medikamentösen Therapie. Die Rezidivraten für symptomatisches und asymptomatisches Vorhofflimmern fielen in der Ablationsgruppe signifikant geringer aus (Ablation 55 % vs. medikamentöse Gruppe 72 % Rezidivrate) [26]. In der med. Therapiegruppe haben im Rahmen des zweijährigen Nachsorgezeitraums darüber hinaus 47,5 % der Patienten bei Ineffizienz der pharmakologischen Therapie eine Katheterablation durchführen lassen.
Bewertet man diese Daten, dann hat die Studie von Nielsen einen entscheidenden Nachteil: Das Kriterium, das in dieser Untersuchung als elektrophysiologischer Endpunkt der Ablation gewählt worden ist (Signalreduktion bzw. keine Signale > 0,2 mV innerhalb des abladierten Areals), entspricht nicht dem international akzeptierten Stand einer kompletten PV-Isolation. Von daher bleibt es offen, wie die Studie mit dem Endpunkt einer PV-Isolation ausgegangen wäre. Dennoch, die Erstbehandlung mit einem Antiarrhythmikum hat eine akzeptable Erfolgsrate! Durch ein intensives Monitoring mittels Event-Rekorder und durch einen akzeptierten elektrophysiologischen Endpunkt ist die RAAFT-2-Studie näher an der aktuellen klinischen Praxis: Die Rezidivrate ist signifikant geringer durch eine Ablationsbehandlung, allerdings muss der Patient eine 7,7 %ige Komplikationsrate akzeptieren. In der klinischen Praxis gewinnt die Aufklärung und Information des Vorhofflimmerpatienten zunehmend an Bedeutung: Patienten, die eine geringe Compliance gegenüber einer medikamentösen Therapie signalisieren und eine möglichst durchgreifende Behandlung eines symptomatischen Vorhofflimmerns anstreben, sind Kandidaten für eine First-line-Ablation. Diese Patienten müssen allerdings über die Komplikationsgefahren einer Ablationsbehandlung adäquat informiert werden!
Rhythmuskontrolle
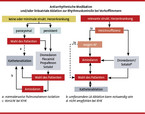
Die antiarrhythmische medikamentöse Therapie ist nach wie vor die Behandlung der ersten Wahl bei Vorhofflimmern (vgl. Abb. 2). Zur Rhythmuskontrolle bei paroxysmalem Vorhofflimmern oder persistierendem Vorhofflimmern nach Kardioversion erfolgt primär eine medikamentöse Therapie mit Betablockern, Dronedaron, Klasse-I- und Klasse-III-Antiarrhythmika. Besondere Bedeutung haben die Prävention von Remodeling und die Behandlung der kardialen Grunderkrankung, z. B. einer hypertensiven Herzerkrankung, erhalten (im Sinne einer "Upstream"-Therapie). Unter diesem Prozedere ist damit zu rechnen, dass ein Jahr nach Kardioversion sich noch ca. 50 – 60 % der Patienten im Sinusrhythmus befinden. Dem steht der Spontanverlauf mit einer Rate von lediglich 20 – 25 % sinusrhythmischer Patienten ohne Antiarrhythmikatherapie gegenüber. Als effektivste Substanz zur Sinusrhythmusstabilisierung gilt das Amiodaron. Insbesondere bei Patienten mit höhergradig reduzierter linksventrikulärer Pumpfunktion und schwerer Herzinsuffizienz stellt bisher Amiodaron das einzige in Europa handelsübliche Antiarrhythmikum dar, das in prospektiven Studien nicht zu einer Mortalitätszunahme führte und daher in dieser Situation Therapie der Wahl ist. Eine breitere Anwendung von Amiodaron zur Rezidivprophylaxe wird jedoch durch die gelegentlichen, zum Teil schwerwiegenden extrakardialen Nebenwirkungen, wie die Lungen- und Hepatotoxizität sowie Induktion einer Hyper- oder Hypothyreose, begrenzt.
Neben einer Dauertherapie mit Antiarrhythmika ist in Einzelfällen auch eine orale Akuttherapie aus Patientenhand als Bolus im Falle einer Vorhofflimmerepisode mit Klasse-IC-Substanzen möglich ("pill-in-the-pocket").
Im Rahmen einer Update-Publikation der Leitlinien aus dem Jahre 2012 wurde von Camm und Koautoren eine Neubewertung der Rhythmuskontrolle vorgenommen [4]. Neben der Möglichkeit einer First-line-Therapie mittels Katheterablation wurde der Stellenwert von Dronedaron im Bereich der medikamentösen Rhythmuskontrolle neu bestimmt: Als Reaktion auf die Daten der PALLAS-Studie und auf die veränderte Zulassung soll Dronedaron nicht mehr bei Patienten mit Herzinsuffizienz bzw. bei anhaltendem (permanentem) Vorhofflimmern zur Anwendung kommen.
Antiarrhythmische Rezidivprophylaxe nach elektrischer Kardioversion: sinnvoll oder nicht?
Kirchhof präsentierte genau zu dieser Frage die Daten der FLEC-SL-Studie [20]: 242 Patienten wurden nach Kardioversion entweder auf eine Therapie mit Flecainid über vier Wochen (Kurzzeittherapie), Flecainid über sechs Monate (Langzeittherapie) oder keine antiarrhythmische Therapie randomisiert: Dabei zeigte sich, dass eine Therapie mit Flecainid keiner antiarrhythmischen Therapie nach Kardioversion überlegen war. Im Vergleich der beiden Konzepte einer Kurzzeit- vs. Langzeittherapie zeigte sich im Rahmen einer Post-hoc-Analyse aller Patienten, die nicht bereits i ersten Monat den primären Endpunkt eines Vorhofflimmerrezidivs erlebten, dass die Langzeittherapie der Kurzzeitbehandlung überlegen ist. Für die klinische Praxis bedeuten diese Ergebnisse, dass man bei einem befürchteten frühen Rezidiv nach Kardioversion mit Flecainid eine nachgewiesene effektive Rezidivprophylaxe betreiben sollte. Bei Patienten, bei denen eine längere Flecainideinnahme möglich ist, sollte diese im Sinne einer möglichst geringen Rezidivrate auch bevorzugt werden; mit einer Kurzzeittherapie von vier Wochen kann man allerdings ca. 80 % der Effizienz einer Langzeittherapie erreichen. Diese Kurzzeittherapie stellt also für eine relevante Zahl an Patienten, die man keiner Langzeittherapie unterziehen möchte (Nebenwirkungen, arrhythmogene Effekte), eine akzeptable Alternative dar.
Upstream-Therapie
Aufgrund der experimentellen Befunde wurden zunächst post hoc große klinische Studien nachanalysiert, um mögliche Effekte einer ACE-Hemmer-Therapie oder auch einer Sartan-Therapie (Blockade des Renin-Angiotensin-Aldosteron-Systems) auf das Auftreten von AF zu belegen [30, 38, 23, 6, 7, 17, 1, 34, 40, 16, 39, 41, 42, 9]. Diese Post-hoc-Analysen konnten zeigen, dass gerade in der Primärprävention die Gabe von ACE-Hemmern oder auch Sartanen bei Patienten mit Herzinsuffizienz bzw. mit arterieller Hypertonie das Auftreten von AF um bis zu 30 % reduzieren kann. Diese Ergebnisse müssen jedoch aufgrund der retrospektiven Datenerhebung an unterschiedlichen Patientenkollektiven eher kritisch gesehen werden.
Neben diesen initialen positiven Befunden vor allen Dingen im Bereich der Primärprävention zeigten aktuelle Metaanalysen jedoch auch, dass es eine erhebliche Heterogenität zwischen den einzelnen Untersuchungen gibt [17, 1, 34]. Die kürzlich publizierte Metaanalyse, die 23 verschiedene Studien mit insgesamt 87 000 Patienten analysierte, konnte zeigen, dass die Gabe eines Angiotensin-II-inhibierenden Pharmaka (ACE-Hemmer, ARB) die Wahrscheinlichkeit des Auftretens von AF signifikant reduziert. Hierbei war jedoch vor allen Dingen im Rahmen der Primärprävention bei Patienten mit Herzinsuffizienz bzw. bei denen mit Hypertonie und bestehender linksventrikulärer Hypertrophie ein positives Resultat zu sehen [34]. Nach Myokardinfarkt bzw. bei Patienten ohne strukturelle Herzerkrankung waren jedoch auch bei dieser Metaanalyse die Ergebnisse nicht positiv.
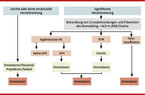
Bezüglich der Sekundärprävention ist zu berücksichtigen, dass in den vielen Studien eine begleitende klassisch antiarrhythmische Therapie, vor allem mit Amiodaron, durchgeführt wurde. Die ANTIPAF-Studie war die erste randomisiert prospektive plazebokontrollierte Multicenter-Studie, die ein Sartan (Olmesartan) gegen Plazebo bei Patienten mit paroxysmalem AF ohne begleitende strukturelle Herzerkrankung untersucht hat. In dieser Untersuchung, in der 420 Patienten insgesamt randomisiert und ausgewertet wurden, zeigte sich kein positiver Effekt auf die Häufigkeit von AF in einem 12-monatigen Follow-up-Intervall [13]. Zur Upstream-Therapie wurden in den letzten Jahren sowohl experimentelle als auch klinische Untersuchungen zur Gabe von ACE-Hemmern, Angiotensin-II-Rezeptorblockern, Aldosteron-Antagonisten, Statinen und Omega-III-Fettsäuren durchgeführt [12, 31, 13, 32, 36, 8, 24, 29]. Upstream-Therapie mit ACE-Hemmern, ARB und Statinen wird aber nicht zur Primärprävention von AF bei Patienten ohne zugrundeliegende kardiovaskuläre Erkrankung empfohlen, sondern kommt nur bei Patienten in Betracht, die aufgrund einer Begleiterkrankung eine Indikation zur Therapie mit ACE-Hemmern, ARB oder Statinen haben (vgl. Abb. 4).
Interessenkonflikte: Der Autor hat keine deklariert.
Auf unserem CME-Portal www.med-etraining.de können Sie ab dem 18.3.2015 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Der Allgemeinarzt, 2015; 37 (22) Seite 22-28