Patienten, die bereits eine TIA oder einen ischämischen Schlaganfall gehabt haben, weisen ein hohes Rezidivrisiko auf. Dieses Risiko kann durch medikamentöse und nicht-medikamentöse Maßnahmen im Rahmen der Sekundärprävention reduziert werden. In dieser Übersichtsarbeit werden aktuelle Aspekte der Sekundärprävention des ischämischen Schlaganfalls dargestellt: Neben den Themen duale Thrombozytenfunktionshemmung (TFH) und neue orale Antikoagulanzien (NOAK) werden die Behandlung des persistierenden Foramen ovale (PFO), die aktuellen Empfehlungen zur Karotisstenose und zur Therapie intrakranieller Stenosen zusammengefasst. Abschließend wird der Stellenwert von Depression und psychosozialem Stress, Ernährung sowie körperlicher Aktivität dargestellt.
Duale Thrombozytenfunktionshemmung (TFH)
Die Monotherapie mit Acetylsalicylsäure (ASS) oder alternativ eine Kombination von ASS und Dipyridamol oder Clopidogrel wird in der Sekundärprävention des ischämischen Schlaganfalls empfohlen. Die Kombination von ASS und Clopidogrel soll bei Patienten mit ischämischem Schlaganfall aufgrund eines erhöhten Blutungsrisikos nicht als langfristige Therapie eingesetzt werden. In verschiedenen Studien konnte keine Überlegenheit einer dualen TFH gegenüber einer Monotherapie nachgewiesen werden [1, 2]. Letztendlich müssen aber die Ergebnisse der laufenden POINT-Studie abgewartet werden, um den Stellenwert einer kurzzeitigen, frühen dualen TFH abschätzen zu können [3].
Fazit: Eine langfristige duale TFH mit ASS und Clopidogrel kann bei Patienten mit ischämischem Schlaganfall nicht empfohlen werden. Eine kurzfristige, frühzeitige duale TFH scheint bei leichten Schlaganfällen und nach TIA einen klinischen Nutzen zu bringen.
Orale Antikoagulation bei kardioembolischem Schlaganfall
Patienten mit Vorhofflimmern (VHF) haben 5-fach höheres Schlaganfallrisiko als Patienten mit Sinusrhythmus [4]. Es wird geschätzt, dass mindestens 15 % aller Schlaganfälle durch VHF verursacht werden. Das Schlaganfallrisiko kann durch eine optimale Antikoagulation mit Vitamin-K-Antagonisten (VKA) und einem INR von 2–3 um 60–70% reduziert werden. Allerdings werden derzeit nur ca. 50 % aller Patienten mit VHF antikoaguliert. Erwähnenswert ist weiterhin, dass sich die meisten Schlaganfälle bei diesen Patienten unter einer suboptimalen Antikoagulation ereignen [5]. Kürzlich wurde von Apostokalis und Kollegen [6] ein Score vorgestellt, der das Risiko einer suboptimalen Einstellung unter VKA abschätzen kann. Insgesamt wurden 9 unabhängige Risikofaktoren identifiziert, welche in dem sogenannten SAMe-TT2-R2 Score zusammengefasst wurden (vgl. Tabelle 1). Eine suboptimale Einstellung ist bei ≥ 2 Punkten wahrscheinlich.
Die neuen oralen Antikoagulanzien (NOAK) haben gegenüber VKA den Vorteil, dass sie in einer fixen Dosis gegeben werden können und keine Überwachung der Gerinnung notwendig ist. Sie weisen auch keine Interaktion mit Nahrungsmitteln und nur wenig Interaktionen mit anderen Medikamenten auf. Die bisher 4 neuen NOAK (Apixaban, Dabigatran, Edoxaban und Rivaroxaban) wurden in großen Studien jeweils mit Warfarin verglichen (RE-LY, ROCKET AF, ARISTOTLE und ENGAGE AF-TIMI 48) [7–10]. In einer kürzlich publizierten Metaanalyse dieser 4 Studien mit 71 683 Teilnehmern reduzierten die NOAK das Risiko eines Schlaganfalls oder einer systemischen Embolie um 19 % [11]. Hierbei war das Risiko für hämorrhagische Schlaganfälle (51 %) und die Gesamtsterblichkeit mit 10 % statistisch signifikant verringert. Die Rate gastrointestinaler Blutungen war bei NOAKs im Vergleich zu Warfarin erhöht. Für die Endpunkte ischämischer Schlaganfall und Myokardinfarkt ergab sich gegenüber Warfarin keine signifikante Reduktion der Ereignisse. Interessant ist weiterhin, dass in dieser Metaanalyse keine Untergruppen identifiziert werden konnten, welche besonders von den NOAK profitierten.
Fazit: NOAK stellen eine Alternative zu Vitamin-K-Antagonisten dar und weisen ein besseres Nutzen-Risiko-Profil auf. Wesentlich in der Sekundärprävention des Schlaganfalls ist die signifikante Reduktion intrakranieller Blutungen.
Thrombolyse unter Behandlung mit NOAK
Zurzeit steht für die NOAK kein Schnelltest zur exakten Spiegelbestimmung zur Verfügung, mit dem die antikoagulatorische Wirkung sicher beurteilt werden kann. Bei unbekanntem Einnahmezeitpunkt und Menge empfiehlt sich folgendes Prozedere [12]: Für Dabigatran belegen Normalwerte von Ecarin-Clotting-Zeit (ECT), Thrombin-Zeit (TT) oder Hemoclot-Test mit hoher Wahrscheinlichkeit das Fehlen von gerinnungsaktiven Dabigatran-Plasmaspiegeln. Die aktivierte partielle Thromboplastin-Zeit (aPTT) erlaubt keine sichere Einschätzung. Rivaroxaban und Apixaban beeinflussen die Anti-Faktor-Xa-Aktivitätsbestimmung. Normalwerte von PTT und Prothrombin-Zeit (PTZ) jenseits der vierten Stunde nach Einnahme von NOAK schließen therapeutische Spiegel, die zu einer klinisch relevanten Erhöhung des Blutungsrisikos führen, weitestgehend aus. Normalwerte dieser beiden Tests allein reichen aber nicht aus, um die Indikation zur Thrombolyse beim akuten Schlaganfall zu stellen. Die Entscheidung für (oder gegen) die systemische Thrombolyse muss individuell getroffen werden. Auf jeden Fall muss über ein erhöhtes Blutungsrisiko unter Thrombolyse aufgeklärt werden, wenn ein Patient innerhalb der letzten 48 Stunden ein NOAK eingenommen hat oder wenn eine relevante Nierenfunktionseinschränkung (Kreatinin-Clearance < 30 ml/min) vorliegt [12].
Fazit: Die Indikation zur systemischen Thrombolyse nach vorangegangener Einnahme von NOAK stellt immer eine Einzelfallentscheidung dar und ist eine "Off-label"-Therapie. Es muss über ein erhöhtes Blutungsrisiko aufgeklärt werden.
Persistierendes Foramen ovale
Ca. 25 % der Bevölkerung weisen ein persistierendes Foramen ovale (PFO) auf. Insbesondere bei jüngeren Patienten mit kryptogenem ischämischem Schlaganfall wird nach einem PFO gesucht, da dies ursächlich für einen Schlaganfall im Rahmen einer paradoxen Embolie sein kann. Tatsächlich findet sich in diesem Kollektiv bei etwa der Hälfte der Betroffenen ein PFO. Als Standardtherapie wird eine medikamentöse Behandlung mit einem TFH empfohlen. Ob der perkutane Verschluss des PFO der medikamentösen Behandlung überlegen ist, war bis vor kurzem nicht ausreichend untersucht. Zwischenzeitlich liegt eine aktuelle Metaanalyse vor [13], in die 14 Studien mit 4 335 Patienten einflossen. Das relative Risiko für einen erneuten Schlaganfall unter PFO-Verschluss betrug bei den randomisierten Studien 0,66 (95 % KI: 0,37; 1,19) und war damit nicht signifikant. Bei den nicht-randomisierten Studien ergab sich eine signifikante Risikoreduktion zugunsten des Verschlusses. Bei Kombination aller Studien zeigte sich eine grenzwertige Signifikanz zugunsten der Intervention. Bei Analyse der Studien mit multivariater Adjustierung fand sich ein Trend zugunsten des PFO-Verschlusses, der aber nicht signifikant war.
Fazit: Der interventionelle Verschluss eines PFO nach kryptogenem Schlaganfall ist nach der aktuellen Datenlage der medikamentösen Behandlung nicht überlegen und sollte nur bei sorgfältig ausgewählten Patienten durchgeführt werden.
Karotisstenose
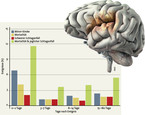
Es wird geschätzt, dass Karotisstenosen für ca. 10–15 % aller ischämischen Schlaganfälle verantwortlich sind. Die Prävalenz steigt bei Menschen ab dem 65. Lebensjahr auf > 5 % an. Die aktualisierten Empfehlungen zur Diagnostik und Therapie der symptomatischen Karotisstenose wurden kürzlich in einer S3-Leitlinie zusammengefasst [14] und sind über die AWMF-Homepage abrufbar (http://www.awmf.org/leitlinien/detail/ll/004-028.html). Die Thrombendarteriektomie (TEA) einer symptomatischen 50- bis 99 %igen Karotisstenose (nach NASCET-Kriterien) kann das 5-Jahres-Schlaganfallrisiko um 5–16 % im Vergleich zur konservativen Therapie senken. Metaanalysen zum Vergleich von Karotis-Stenting (CAS) und TEA belegen, dass die CAS mit einer um 2–2,5 % höheren periprozeduralen Schlaganfall- und Todesfallrate und einer um 0,5–1 % niedrigeren periprozeduralen Rate an Myokardinfarkten assoziiert ist. Die TEA stellt daher zurzeit bei nicht erhöhtem Op.-Risiko das Standardverfahren dar. Eine CAS kann als eine Alternative zur TEA erwogen werden, wenn eine prozedurale Schlaganfallrate/Letalität von unter 6 % eingehalten wird [14]. Bisher wurde davon ausgegangen, dass eine TEA nach einer TIA oder einem leichten Schlaganfall möglichst unverzüglich erfolgen sollte. Eine prospektive schwedische Registeranalyse [15] mit 2 596 Patienten, bei denen eine TEA wegen einer hochgradigen symptomatischen Karotisstenose erfolgte, ergab das geringste Risiko für ein periprozedurales Ereignis bei einer Operation innerhalb von 3–7 Tagen nach dem Ereignis. Sowohl frühere als auch spätere Operationen waren mit einem höheren Risiko assoziiert (Abb. 1).
Fazit: Eine TEA bei hochgradiger symptomatischer Karotisstenose (TIA, "Minor Stroke") sollte optimalerweise zwischen 3 und 7 Tagen nach dem Ereignis durchgeführt werden.
Intrakranielle Stenose
Die optimale Therapie symptomatischer intrakranieller Stenosen war bisher nicht eindeutig geklärt. Neben einer aggressiven konservativen Therapie wurden in letzter Zeit zunehmend interventionelle Verfahren mit Angioplastie und Stenting (PTAS) eingesetzt. In der randomisierten SAMPRIS-Studie wurde die Effektivität der PTAS mittels Wingspan-System zusätzlich zu einer optimierten medikamentösen Therapie (duale TFH für 90 Tage, Risikofaktorenkontrolle) im Vergleich zur alleinigen optimierten medikamentösen Therapie bei Patienten mit hochgradiger symptomatischer intrakranieller Stenose (70–99%) untersucht. Die Studie wurde vorzeitig nach 451 Patienten abgebrochen, da in der PTAS-Gruppe in den ersten 30 Tagen signifikant mehr Endpunkte (Schlaganfall und Tod) auftraten (14,7 % vs. 5,8 %; p=0,002) [16]. Auch Patienten, bei denen der Schlaganfall bereits unter TFH aufgetreten war, profitierten nicht von der zusätzlichen PTAS. Aus der Studie lässt sich ableiten, dass eine duale TFH mit Clopidogrel und ASS für 90 Tage kombiniert mit einer Optimierung anderer Risikofaktoren eine sehr wirksame Behandlung der symptomatischen intrakraniellen Stenose darstellt.
Fazit: Die alleinige optimierte konservative Therapie der symptomatischen intrakraniellen Stenose ist der zusätzlichen PTAS überlegen und mit nur wenigen neuen Ereignissen im weiteren Verlauf assoziiert.
Depression und psychosozialer Stress
Die Bedeutung von psychosozialem Stress und dessen Auswirkungen auf zerebrovaskuläre Erkrankungen wie z. B. Schlaganfall wurde in den letzten Jahren intensiver untersucht. Zwei kürzlich publizierte Metaanalysen ergaben eine signifikante Erhöhung des Schlaganfallrisikos bei depressiven Symptomen [17, 18]. Depressive Personen zeigten ein um 45 % erhöhtes Schlaganfallrisiko. Zwischenzeitlich legen aktuelle Studien nahe, dass nicht nur die Depression selbst als Risikofaktor gilt, sondern vielmehr bereits eine erhöhte psychische Belastung. Die Ergebnisse der INTERSTROKE-Studie [19] belegen, dass psychische Belastung und Depression unabhängige Risikofaktoren für den ischämischen Schlaganfall darstellen. In einer kürzlich publizierten Studie konnte gezeigt werden, dass psychosoziale Belastung auch bei älteren Patienten (> 65 Jahre) ein unabhängiger Risikofaktor für einen ischämischen Schlaganfall ist. Es zeigte sich eine klare Dosis-Wirkungsbeziehung, d. h. je höher der Stress, desto höher das Schlaganfallrisiko. Für Studienteilnehmer mit der stärksten psychosozialen Belastung war das Risiko, an einem Schlaganfall zu sterben, dreimal so hoch wie für jene, die weniger emotionalen Stress empfanden [20].
Fazit: Psychosoziale Belastung und Depression stellen unabhängige Risikofaktoren für einen Schlaganfall dar.
Ernährung
Eine gesunde ausgewogene Ernährung zählt mit zu den wichtigsten nicht-medikamentösen Behandlungsfaktoren in der Prävention von Schlaganfällen.
Elektrolyte
Im Rahmen der Prävention kardiovaskulärer Ereignisse wird seit vielen Jahren eine salzarme Kost empfohlen. Die Einnahme von 5 g Kochsalz am Tag erhöht das Schlaganfallrisiko um 23 % [21]. Eine Reduktion um 2 g/d reduziert die Häufigkeit kardiovaskulärer Ereignisse um 20 %. Die American Heart Association empfiehlt sogar eine Reduktion des täglichen Salzkonsums auf weniger als 1,5 g. In der Northern Manhattan Study zeigte sich ein 17 %iger Anstieg des Schlaganfallrisikos pro 500 mg Anstieg des Salzkonsums [22]. Im Gegensatz zu Natrium erniedrigt Kalium das Schlaganfallrisiko. Der Zusatz von 1 g Kalium am Tag führt zu einer Reduktion des Schlaganfallrisikos um 11 % [21]. Für Kalzium finden sich keine positiven Effekte, allerdings kann ein erhöhtes Kalzium das Risiko für kardiovaskuläre Erkrankungen erhöhen [23].
Obst, Gemüse und Ballaststoffe
Eine ballaststoffreiche Ernährung hat nachgewiesenerweise einen positiven Einfluss auf zahlreiche vaskuläre Risikofaktoren wie Hypertonus, Fettstoffwechselstörungen und Diabetes mellitus. Larsson et al. [24] konnten eine relative Risikoreduktion für den Schlaganfall von 13 % nachweisen. Auch in diesem Kollektiv bestätigte sich der Vorteil von weißem Obst und grünem Gemüse. Personen mit hoher Ballaststoffaufnahme hatten ein signifikant geringeres Schlaganfallrisiko. Die Dosis-Wirkungsbeziehung war linear.
Vitamine
Zahlreiche Studien zeigten einen inversen Zusammenhang zwischen den Vitamin-A- und -E-Spiegeln und kardiovaskulären Ereignissen. Im Gegensatz dazu konnten Interventionsstudien diese Ergebnisse nicht bestätigen [21]. In einer Metaanalyse zeigte sich durch die Gabe von Vitamin E keine Reduktion von Schlaganfällen, allerdings erhöhte sich in diesem Kollektiv das Risiko für zerebrale Blutungen. Auch Vitamin A verfehlte den Nachweis einer Reduktion des Schlaganfallrisikos, bei einem gleichzeitigen Anstieg der Gesamtmortalität. Die Gabe von Vitamin C reduziert weder das Risiko für Schlaganfälle noch das kardiovaskuläre Risiko. Die Gabe von B-Vitaminen (B6, Folsäure und B12) senkt das Homocystein, das als kardiovaskulärer Risikofaktor diskutiert wird. In den letzten Jahren wurden 3 große Studien zur Sekundärprävention vaskulärer Ereignisse zu diesem Thema publiziert [25, 26, 27], in denen sich kein signifikanter Unterschied im Vergleich zu Plazebo zeigte. Eine Metaanalyse von 8 randomisierten Studien über Folsäure, die auch Schlaganfall als Endpunkt beinhalteten, ergab eine Risikoreduktion von 18 % durch die Gabe von Folsäure. Wichtig für diesen Effekt, der nur in der Primärprävention nachweisbar war, schien die Gabe über mindestens 3 Jahre und eine Reduktion des Homocysteins von mehr als 20 % zu sein [28].
Fazit: Eine Reduktion des täglichen Salzkonsums schützt vor einem ischämischen Schlaganfall, hingegen wirkt Kaliumzufuhr protektiv. Ein erhöhter Kalziumwert kann das Risiko kardiovaskulärer Erkrankungen erhöhen. Hoher Konsum von Obst, Gemüse und Ballaststoffen schützt effektiv vor Schlaganfällen. Die Vitamine A, E und C senken das Schlaganfallrisiko nicht, sondern erhöhen unter Umständen sogar das Risiko für kardiovaskuläre Ereignisse.
Körperliche Aktivität
Dass körperliche Aktivität effektiv vor einem Schlaganfall schützen kann, ist durch viele Studien belegt und findet sich in allen Empfehlungen zur Primär- und Sekundärprävention vaskulärer Ereignisse und des Schlaganfalls. Durch regelmäßige körperliche Aktivität reduziert sich das Schlaganfallrisiko um 25 bis 30 % [29]. In den Leitlinien wird eine moderate körperliche Aktivität von 150 min. pro Woche oder eine intensive Aktivität von 75 min. pro Woche empfohlen. Eine weitere Steigerung der Aktivität führt zu einer Zunahme der Risikoreduktion [30].
Interessenkonflikte: Die Autoren haben keine deklariert.
Erschienen in: Der Allgemeinarzt, 2014; 36 (20) Seite 44-50