Annähernd jeder dritte Mann leidet unter „gutartigen Prostatabeschwerden“. Beschwerden beim Wasserlassen, die durch eine vergrößerte Prostata oder eine Abflussbehinderung entstehen, haben eine statische und eine dynamische Komponente. Danach richten sich die Therapiemöglichkeiten. Wann „Abwarten“ gerechtfertigt ist, wann eine medikamentöse Behandlung und wann chirurgische Maßnahmen infrage kommen, soll im folgenden Beitrag dargestellt werden.
Früher wurden Beschwerden beim Wasserlassen, besonders ab dem mittleren Lebensalter, automatisch einer vergrößerten Prostata zugeschrieben. Heute weiß man, dass Symptome des unteren Harntrakts verschiedenste Ursachen haben können. Es wurde daher der Überbegriff LUTS (Lower Urinary Tract Symptoms) eingeführt. Ein LUTS kann auch durch eine anderweitige Abflussbehinderung, zum Beispiel im Bereich der Harnröhre, oder eine funktionelle Obstruktion durch Veränderungen der Blasenwand, durch Infektionen, neurologische Erkrankungen oder psychogene Faktoren und nicht zuletzt durch Tumoren zustande kommen.
Für Beschwerden, die wirklich von der Prostata ausgehen, wurden die Begriffe BPE (Benigne Prostatic Enlargement), also gutartige Vergrößerung der Prostata, und – wenn diese eine Abflussbehinderung verursacht – BPO (Benigne Prostatic Obstruction) eingeführt. Der traditionelle Begriff BPH (Benigne Prostatic Hyperplasia) wird zwar noch allgemein, sozusagen "medizinisch umgangssprachlich" für eine Prostatavergrößerung verwendet, ist aber streng genommen eine rein histologische Definition.
Einteilung der LUTS
Die LUTS-Symptome selbst können in solche der Miktions- bzw. Entleerungsphase und solche der Speicherphase unterteilt werden, wobei letztere in der Regel für die Betroffenen viel belastender sind, nicht zuletzt deshalb, weil sich die Blase zu 99 % der Zeit in der Speicherphase befindet. Unter erstere, welche als obstruktive Symptome bezeichnet werden, fallen die Startschwierigkeiten, das verlängerte Harnlassen bei abgeschwächtem Harnstrahl, das sogenannte Harnstottern bei Nachhelfen mit der Bauchpresse, Restharngefühl und Nachträufeln, wobei letzteres auch durch einen schwachen Musculus bulbospongiosus verursacht sein kann.
Die Symptome der Speicherphase werden auch als irritativ bezeichnet und äußern sich in Pollakisurie, also dem häufigen Harnlassen, Nykturie (nächtliches Harnlassen), einem überfallsartig auftretenden und schwer kontrollierbaren, sogenannten imperativen Harndrang bis hin zur Dranginkontinenz, also unwillkürlichen Harnverlust durch unkontrollierbaren Harndrang. Insbesondere in den frühen Stadien der gutartigen Prostatavergrößerung können die Beschwerden undulierend verlaufen und sich sogar in bis zu 25 % der Fälle spontan wieder bessern.
Pathogenese von LUTS
Die durch die BPH/BPE hervorgerufene Harntraktsymptomatik setzt sich aus einer dynamischen und einer statischen Komponente zusammen:
Die dynamische Komponente wird durch den Tonus der glatten Muskulatur im Bereich von Trigonum, Blasenhals und Prostatakapsel bestimmt, welcher vor allem über α1-Rezeptoren reguliert wird. Die BPH hat einen höheren Anteil (ca. 60 %) an glatten Muskelzellen als die nicht hyperplastische Prostata (ca. 40 %). α1-Rezeptorenblocker sollten daher die dynamische Komponente beeinflussen.
Die statische Komponente wird durch das wachsende Adenom bestimmt. Dieses steht unter dem Einfluss des Hauptandrogens Testosteron, wobei in der Prostatastromazelle auch Östrogene proliferativ wirken.
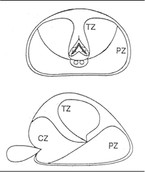
Die gutartige Vergrößerung der Prostata geht in erster Linie von der unmittelbar um die Harnröhre gelegenen Transitional- (TZ) und Zentralzone (CZ) aus, weshalb frühzeitig Symptome der Harnentleerung auftreten können. Prostatakarzinome entstehen primär in der peripheren Zone (PZ), weshalb Symptome in der Regel erst bei lokal fortgeschrittenen Stadien auftreten (Abb. 1).
Diagnostik
Die urologische Abklärung von Patienten mit LUTS umfasst obligatorisch:
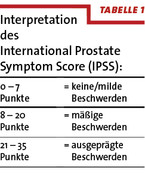
- die Erfassung der Symptome, gegebenenfalls standardisiert mittels eines WHO-validierten Fragebogens des IPSS (International Prostate Symptom Score) (Tabelle 1)
- eine klinische Untersuchung inklusive digital-rektaler Untersuchung
- den Harnbefund
- eine Serum-PSA-Analyse
- eine sonographische Restharnkontrolle
sowie fakultativ:
- eine funktionelle Abklärung inklusive Harnflussmessung und
- die Abklärung des oberen Harntraktes (am besten mittels Ultraschall).
Bei Patienten mit mäßiger und ausgeprägter Symptomatik, mit einer maximalen Harnflussrate < 10 – 15 ml/s und einem Restharn > 50 ml müssen alle möglichen Therapieoptionen diskutiert und angeboten werden. Vor allem bei jüngeren Patienten und unklarer Befundkonstellation muss vor einer geplanten invasiven Therapie eine weiterführende urodynamische Diagnostik (Druck-Fluss-Studie bzw. Urodynamik) veranlasst werden.
Therapie
Wait & Watch – kontrolliertes Beobachten
Patienten mit geringer Beschwerdesymptomatik ohne subjektiven Leidensdruck, ohne Anzeichen einer beginnenden Detrusordekompensation, mit einer nur gering bis mäßiggradig vergrößerten Prostata und einem altersentsprechend normalen PSA-Wert können auch ohne sofortige Therapiemaßnahmen regelmäßig kontrolliert werden, zumal sich häufig langandauernde Remissionen der Beschwerden einstellen können.
Phytopharmaka
Die ältesten, jedoch auch umstrittensten Präparate zur Behandlung von LUTS bei BPH/BPE sind die Phytopharmaka. Eine Reihe von Wirkungsmechanismen werden postuliert, u. a. Beeinflussung der Prostaglandinsynthese in der Prostata und dadurch entzündungshemmende und abschwellende Wirkung, Veränderung der Sex-Hormon-Bindungsglobulin-Synthese, Hemmung der 5α-Reduktase-Aktivität bzw. Androgenrezeptorblockade und Apoptoseinduktion. In den wenigen vorliegenden plazebokontrollierten bzw. Vergleichsstudien mit α1-Rezeptorblockern und 5α-Reduktase-Hemmern über mindestens zwölf Monate fanden sich zwar interessante Ergebnisse, der definitive Wirkungsnachweis konnte aber nicht zweifelsfrei erbracht werden. Laut WHO-BPH-Konsensuskonferenz handelt es sich bei den Phytopharmaka um einen interessanten Therapieansatz, welcher sowohl experimentell als auch klinisch weiter verfolgt werden sollte. Phytopharmaka wirken oft bei vorwiegend irritativen Beschwerden und haben praktisch keine Nebenwirkungen.
α1-Rezeptorblocker
α1-Rezeptorblocker wirken über die dynamische Komponente der BPH. Außerdem wird ein Apoptose-induzierender Effekt (Doxazosin) diskutiert. Für alle gängigen α1-Rezeptorblocker (Alfuzosin-SR, Doxazosin, Terazosin, Tamsulosin, Silodosin) liegen eine Vielzahl von prospektiven, plazebokontrollierten Studien vor. In diesen konnte reproduzierbar eine bis zu 25 %ige Verbesserung des Harnflusses und eine etwa 30 – 40 %ige Reduktion der Symptome, insbesondere auch einer Drangsymptomatik, nachgewiesen werden. Die klinische Effizienz ist bei den erwähnten α1-Blockern vergleichbar, die Fragen nach Verträglichkeit und Darreichungsform treten in den Vordergrund. Die Wirkung tritt innerhalb von sieben bis zehn Tagen ein, setzt man das Medikament ab, treten die Beschwerden wieder auf.
Hinsichtlich des Nebenwirkungsprofils scheinen Alfuzosin-SR sowie Tamsulosin den beiden anderen Substanzen leicht überlegen zu sein und weniger Schwindel, Abgeschlagenheit und Schläfrigkeit zu bewirken. Allerdings werden für Tamsulosin häufiger Ejakulationsstörungen berichtet. Bei gleichzeitiger antihypertensiver Behandlung mit Kalziumantagonisten, ACE-Hemmern oder α-Blockern ist Vorsicht geboten.
5α-Reduktasehemmer
Es handelt sich dabei um Blocker der 5α-Reduktase, welche Testosteron in das eigentlich intrazellulär biologisch wirksame Dihydrotestosteron (DHT) umwandelt. Finasterid (Proscar®) hemmt hierbei nur 5αR Typ 2, während Dutasterid (Avodart®) beide Isoenzyme blockiert. Klinische Effizienz und Verträglichkeit der 5αR-Inhibitoren (5αRI) wurden in einer Reihe von prospektiven, plazebokontrollierten Studien nachgewiesen, wobei kein wesentlicher Unterschied zwischen beiden Substanzen festgestellt wurde. Unter 5αRI kommt es durchschnittlich zu einer 15 – 20 %igen Reduktion des Prostatavolumens, zu einer Verbesserung des maximalen Harnflusses um 1,5 – 2,0 ml/s und zu einer signifikanten Verringerung der Symptome. Die Rate an Harnverhaltungen wurde um 57 %, jene an notwendigen operativen Interventionen um 48 % gesenkt, wobei die absolute Zahl an derartigen Ereignissen an sich sehr niedrig war. Die Wirkung setzt nur langsam ein und kann erst nach frühestens drei Monaten beurteilt werden.
Das Prostata-spezifische Antigen (PSA) wird um ca. 50 % vermindert, das Serum-Testosteron verändert sich nicht. Das Medikament ist nebenwirkungsarm, lediglich hinsichtlich der Vita sexualis (Verminderung der Libido, Impotenz, Verminderung des Ejakulationsvolumens und Ejakulationsstörungen) werden Nebenwirkungen bei einem geringen Prozentsatz (< 5 %) beobachtet. Die Wirkung der 5αRI zeigt sich vor allem bei einem Prostatavolumen > 40 ml.
Kombinationstherapie
Im Rahmen der MTOPS-Studie (Medical Therapy Of Prostate Symptoms) war eine Therapie mit Finasterid bzw. mit der Kombination Finasterid und Doxazosin einer alleinigen α1-Rezeptorenbehandlung bzw. einer Plazebogruppe deutlich überlegen, die Kombination verminderte die Inzidenz an Harnverhaltungen im Laufe von fünf Jahren Therapie um 79 %, jene an operativen Eingriffen um 69 %. In der CombAT (Combination of Avodart and Tamsulosin)-Studie wurde die bessere Wirksamkeit der Kombination α1-Rezeptorenblocker plus 5αRI gegenüber einer Monotherapie mit Dutasterid bzw. Tamsulosin hinsichtlich BPH-Progression und Symptom-Milderung über einen Beobachtungszeitraum von vier Jahren bestätigt. Dutasterid-Monotherapie und die Kombinationstherapie verminderten bei größeren Drüsen (Ø 55 ml) signifikant das Risiko einer Harnverhaltung und einer Operation (jeder 8. unter Tamsulosin- und nur jeder 23. unter Kombinationstherapie).
Das heißt, dass bei Drüsen > 50 ml mit einer Kombinationstherapie begonnen werden soll und nach etwa ½ Jahr versucht werden kann, den α1-Rezeptorblocker abzusetzen und zu kontrollieren, ob sich die Symptomatik wieder verschlechtert.
Bei Patienten, bei denen die irritative Symptomatik im Vordergrund steht, das Prostatavolumen < 40 – 50 ml beträgt, keine wesentlichen Restharnmengen (> 50 ml) festgestellt werden können und bei denen eine alleinige α1-Rezeptorblocker-Therapie keine ausreichende Besserung der Drangsymptomatik gebracht hat, ist nach heutigen Erkenntnissen der Versuch einer Kombinationstherapie mit einem Anticholinergikum (z. B. Trospiumchlorid oder Tolterodin) unter entsprechender Restharnkontrolle möglich.
Phosphodiesterasehemmer
PDE5-Hemmer sind in der Therapie der erektilen Dysfunktion Mittel der ersten Wahl. Da PDE5-Isoenzyme praktisch im gesamten unteren Harntrakt vorhanden sind und LUTS und erektile Dysfunktion eine starke Assoziation aufweisen, war es naheliegend, die Wirkung der PDE5-Inhibitoren bei LUTS zu untersuchen. Tadalafil scheint aufgrund seiner langen Halbwertszeit und der bereits etablierten täglichen 5-mg-Dosierung für eine Dauertherapie am besten geeignet. Studiendaten zeigen eine signifikant stärkere Verbesserung des IPSS gegenüber Plazebo und eine vergleichbare mit Tamsulosin. Dies führte zu einer Erweiterung der Zulassung von Tadalafil für die Indikation benignes Prostatasyndrom.
Chirurgische Prostatektomie
Die transurethrale Elektroresektion der Prostata (TURP) und die offene Prostatektomie (bei Prostatavolumina > 80 – 100 ml) gelten nach wie vor als "Goldstandard" in der Therapie von Patienten mit ausgeprägter Symptomatik und höhergradiger oder schwerer BPO (vgl. Tabelle 2). Weder medikamentöse noch minimal invasive Therapien erreichen die klinische Effizienz der TURP. Die Morbidität hat sich im Laufe der Jahre deutlich gesenkt, die Notwendigkeit einer Bluttransfusion liegt bei 5 – 10 %, 8 – 15 % der Männer müssen innerhalb von zehn Jahren reoperiert werden.
Wesentlichste Nebenwirkung der TURP ist die retrograde Ejakulation in 25 – 99 %. Der Ejakulationsverlust ist mit einem negativen Einfluss auf das Sexualleben assoziiert. Die TURP hat durch Entwicklung der bipolaren Resektionstechnik in Kochsalzlösung eine weitere Verbesserung erfahren und die Komplikations- bzw. Nebenwirkungsrate weiter verringert. Als Alternative zur offenen Prostatektomie wird bei großen Adenomen vereinzelt die extra-peritoneale endoskopische ("laparoskopische") Prostatektomie modifiziert nach Millin angewandt. Als echte Alternative, insbesondere bei Adenomen zwischen 100 und 150 ml Volumen, hat sich die Laser-Enukleation etabliert.
Laserprostatektomie
Durch die Einführung des KTP- oder Green- Light-Lasers hat die Laserprostatektomie in ihren verschiedenen Varianten eine Wiederbelebung erfahren. Vorteil des KTP-Lasers ist die hervorragende Blutstillung, wodurch auch antikoagulierte Patienten operiert werden können. Durch die kontinuierliche Steigerung der Watt-Leistung auf zuletzt 180 W können nun auch größere Adenome mit dem KTP-Laser in einem akzeptablen Zeitrahmen abladiert werden. Der gepulste Holmium-Laser kann auch zur Enukleation mit anschließender Morcellation und Absaugung der Gewebeteile in bzw. aus der Blase angewendet werden. Dadurch können auch, wie bereits oben erwähnt, größere Adenome transurethral behandelt werden. Prinzipiell dieselbe Technik kann auch mit dem Thulium-Dauerstrich-Laser angewendet werden. Nach Laserprostatektomie muss mitunter mit einer verlängerten postoperativen Dysurie gerechnet werden.
Minimal invasive Verfahren
In den letzten 15 Jahren wurden eine Reihe minimal invasiver Therapieoptionen wie die transurethrale Mikrowellenthermotherapie oder die TUNA-Technik entwickelt. Während die perioperative Komplikationsrate gering ist, ist die Rate der notwendigen Reoperationen hoch und erreicht innerhalb eines Jahres Werte, die nach TURP kaum in zehn Jahren erreicht werden. Dadurch hat das Interesse an diesen Methoden zuletzt auch wieder abgenommen.
Fazit
Das Wichtigste in Kürze
Histologische Veränderungen im Sinne einer BPH sind erstmals in der dritten Lebensdekade nachweisbar, im Alter von 80 bis 90 Jahren ist nahezu jeder Mann betroffen. Die Hälfte der Männer mit BPH entwickeln eine klinisch vergrößerte Prostata und wiederum die Hälfte davon Miktionsbeschwerden, welche heute spezifischer als untere Harntraktsymptomatik (LUTS) bezeichnet werden sollten. Die funktionelle Diagnostik von Männern mit unterer Harntraktsymptomatik umfasst subjektive und objektive (Harnfluss, Restharn) Parameter. Das therapeutische Spektrum hat sich in den letzten zwei Dekaden wesentlich verändert, heute stehen effiziente Medikamente und vorwiegend gering invasive chirurgische Therapieoptionen zur Prostatektomie zur Verfügung.
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2014; 36 (18) Seite 38-44