Den Überblick über die modernen Behandlungsverfahren chronischer Wunden zu behalten, ist bisweilen schwierig. Dies liegt jedoch eher an einem immer größer werdenden Angebot an Produkten im Bereich der Wundverbände und weniger an einem Wandel der zugrundeliegenden Prinzipien der Wundtherapie. Die meisten chronischen Wunden können durch eine gezielte Behandlung der Wundursache sowie eine optimale Wundbettvorbereitung zur Abheilung gebracht werden. Ziel dieses Artikels ist es, eine aktuelle Übersicht über die Prinzipien und Möglichkeiten der lokalen Wundbehandlung zu geben.
Ein entscheidender und richtungsweisender Bestandteil des Wundmanagements bleibt die Abklärung der Ätiologie der Wunde oder vielmehr der gestörten Wundheilung, falls diese nicht offenkundig ist. Infrage kommen vaskuläre (z. B. venös, arteriell, gemischt venös-arteriell), traumatische oder druckbedingten sowie infektiöse, metabolische (Diabetes), immunologische oder neoplastische Ursachen. Deren spezifische Therapie, wie z. B. Kompression, Revaskularisierung oder pharmakologische Interventionen (Antibiotika oder Immunsuppressiva), kann den Heilungsablauf entscheidend beeinflussen und verkürzen. Des Weiteren sollte eine Mangelernährung behoben werden.
Mit der lokalen Wundtherapie schafft man darüber hinaus das ideale Milieu für eine gute Wundheilung. Im Mittelpunkt steht dabei die Schaffung eines Wundgrundes, der gut durchblutet, frei von nekrotischem Gewebe und mit möglichst wenigen Bakterien besiedelt ist. Zudem ist eine gute Feuchtigkeitsbalance (Kontrolle des Exsudats) für die Wundheilung förderlich. Im Folgenden sollen einige grundlegende Prinzipien zur Schaffung eines solchen idealen Wundgrundes beschrieben werden.
Wundreinigung: Wundspülung und Desinfektion
Die Wundspülung dient zur Reduktion der Bakterienlast und zum Entfernen von losem Material. Zum Spülen eignet sich am besten isotonische Kochsalzlösung. Bei kritischer bakterieller Besiedlung kann die Bakterienlast durch eine Druckspülung (Wasserstrahldébridement) noch besser gesenkt werden. Die Sorge, dabei die Erreger in umliegendes Gewebe auszuschwemmen oder gar eine Bakteriämie zu verursachen, scheint unbegründet zu sein. In diesen Fällen kann auch eine Behandlung mit Antiseptika angezeigt sein. In vitro zeigen antimikrobielle und antiseptische Substanzen jedoch nicht nur antiseptische Wirksamkeit, sondern auch reizende Eigenschaften und Zytotoxizität, also eine hemmende Wirkung auf Fibroblasten, Keratinozyten und Leukozyten (Hemmung der Gewebsneubildung). Andererseits konnte für einzelne Wundspüllösungen (z. B. Octenidin, Polyhexanid) eine gute Gewebsverträglichkeit ohne zytotoxische Effekte nachgewiesen werden. Weitere oft angewendete antiseptische, gut verträgliche Produkte enthalten Silber oder Jod in einer Slow-Release-Formulierung (Cadexomer iodine). Lokale Antibiotika sollten aufgrund der Gefahr von Resistenzbildung und von allergischen Sensibilisierungen vermieden werden.
Débridement
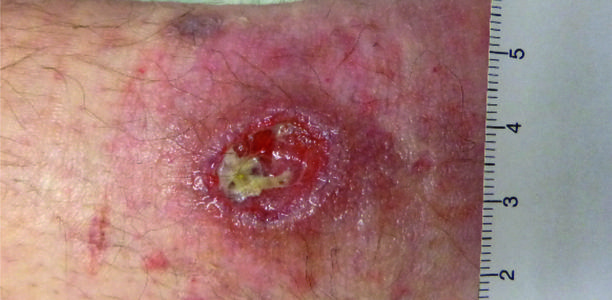
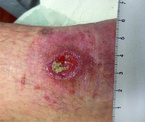
Chronische Wunden sind oft von sogenannten Biofilmen überzogen. Diese bestehen aus Mikroorganismen, eingebettet in eine Matrix aus Polysacchariden und Proteinen, die sie vor dem Angriff durch die Immunabwehr und vor antimikrobiellen Substanzen schützt (Abb. 1). Typische Biofilmbildner sind u. a. Pseudomonas aeruginosa und Koagulase-negative Staphylokokken. Beim Débridieren werden solche Biofilme und nekrotische Anteile der Wunden entfernt. Ein weiterer Effekt ist das Anregen der Wundheilung bei einer chronischen, stationären Wunde, welche dadurch in eine akute Wunde transformiert wird. Zudem kann durch das Débridement die bakterielle Last vermindert werden, da sich Bakterien bevorzugt an Nekrosen ansiedeln (Abb. 2). Das Débridement ist die Basis jeder lokalen Wundbehandlung und kann bei praktisch jeder Wunde angewendet werden. Eine Ausnahme bilden das Pyoderma gangraenosum (Pathergiephänomen) oder frisch granulierende Wunden, bei denen die Gewebsneubildung nicht zerstört werden darf. Das Débridement sollte je nach Ausmaß der Nekrose- oder Fibrinanteile regelmäßig wiederholt werden. Ein Risiko beim Débridement ist das Verletzen von vitalem und neu gebildetem fragilem Gewebe sowie die Entstehung von Schmerzen. Es gibt verschiedene Formen des Débridements, jedoch keine Evidenz darüber, welche Form zu bevorzugen ist. Das Débridement sollte individuell aufgrund von Patient, Art der Wunde, Verfügbarkeit der Mittel und Kosten ausgewählt werden.
Nass-Trocken-Phase
Die Nass-Trocken-Phase ist eine sehr häufig angewandte und einfache Form des Débridements durch Wundreinigung und Anregung der Wundheilungskaskade, unter anderem durch Schaffung eines leicht blutenden Wundbettes. Das Prinzip ist sehr einfach: Mehrere z. B. mit Kochsalz- oder Ringerlösung getränkte Gazen werden für einige Minuten auf die Wunde und den Wundrand gelegt. Anschließend werden diese und die dadurch aufgeweichten nekrotischen Anteile entfernt. Bei der Trockenphase werden trockene Gazen aufgelegt, um die vermehrte Flüssigkeit wieder aufzunehmen.
Mechanisches Débridement
Beim mechanischen Débridement wird avitales Gewebe mit sterilen Tupfern und stumpfen Instrumenten abgetragen. Zum mechanischen Débridement gehören auch das Spülen der Wunde sowie die Ultraschall-assistierte Wundbehandlung. Die Ultraschallwellen führen in Verbindung mit der Spülung zur Auflösung der Nekrosen und des Wunddébris (Cavitation) sowie zu biochemischen Veränderungen, welche die Wundheilung positiv beeinflussen (acoustic streaming).
Scharfes/chirurgisches Débridement
Beim scharfen Débridement werden die nekrotischen Gewebsanteile mit sterilen Instrumenten wie Skalpell, Schere, Kürette oder scharfem Löffel entfernt. Diese effiziente Methode ist oft durch Schmerzen limitiert, welche durch vorangehendes Auftragen einer lokalanästhetisch wirkenden Creme verringert werden können. Das chirurgische Débridement wird unter Narkose durch einen Chirurgen durchgeführt. Es ist die schnellste Form des Débridements und sehr effektiv, jedoch zeit- und kostenaufwendig und mit dem größten Verletzungsrisiko verbunden.
Autolytisches Debridment
Diese Form des Débridements gilt als eine der sichersten, da praktisch nur avitales Gewebe entfernt wird. Das Prinzip besteht darin, die Wunde z. B. mit Hydrokolloiden oder Hydrogelen unter Okklusion feucht zu halten, so dass in dieser optimalen Wundumgebung die körpereigenen Enzyme die nekrotischen Anteile der Wunde auflösen können.
Biologisches Débridement
Mit biologischem Débridement (auch Biotherapie oder Biochirurgie genannt) ist die Therapie mit Maden (meist Maden der Goldfliege Lucilia sericata) gemeint. Die lebenden, sterilen Maden werden entweder lose oder in einem Beutel auf die Wunde gelegt und für 48 bis 72 Stunden belassen. Einerseits scheiden die Maden im Rahmen einer extraintestinalen Vorverdauung ein eiweißauflösendes Sekret aus, das die Nekrosen aufweichen kann, andererseits ernähren sich die Maden nur von totem Material und verschonen das vitale Gewebe. Zudem geht man von antimikrobiellen Effekten aus und das Granulationsgewebe wird durch die Sekretion verschiedener Stoffe durch die Maden angeregt. Bei dieser Form des Débridements haben Pflegende manchmal gemischte Gefühle, da die Vorstellung, lebendige Maden auf sich zu tragen, etwas unangenehm sein könnte. Von den Patienten wird die Biotherapie dagegen meistens überraschend gut akzeptiert.
Wundauflagen
War man bis zur Mitte des 20. Jahrhunderts noch der Meinung, dass Wunden luftgetrocknet am besten heilen, hat hier in den 60er-Jahren ein Paradigmenwechsel hin zur feuchten Wundbehandlung stattgefunden. Zahlreiche Experimente und klinische Studien haben in der Zwischenzeit den Nachweis erbringen können, dass die Erhaltung eines feuchten Wundmilieus der trockenen Wundbehandlung überlegen ist. Damit wurde die Regel „trocken auf trocken“ und „feucht auf feucht“ ins Reich der Mythen befördert. Einerseits wird die Keratinozytenmigration durch das feuchte Milieu erleichtert, andererseits kann ein autolytisches Débridement stattfinden. Zudem werden die Schmerzen durch das Feuchthalten der Wunde reduziert, so dass die Lebensqualität der Patienten verbessert wird. Bei der großen Auswahl von Wundauflagen ist es heutzutage sehr schwierig, die richtige zu finden, insbesondere, da es nicht eine universelle Wundauflage gibt, die für alle Wunden passt. Bei der Wahl der Wundauflage ist die Erhaltung der Feuchtigkeitsbalance das Wichtigste. Einen Überblick über häufig angewendete Wundauflagen gibt Tabelle 1.
Um die bakterielle Besiedlung einer Wunde zu hemmen, haben viele der oben beschriebenen Wundauflagen zusätzlich noch Produktlinien mit Silberzusatz. Hier können prinzipiell zwei Arten unterschieden werden: Produkte, die Silberionen ins Gewebe abgeben, und Produkte, bei denen die Silberionen auf der Wundauflage verbleiben, sodass sie nur im aufgenommenen Exsudat bakterizid wirken können. Bei stark geruchsbildenden Wunden können Aktivkohlenverbände angewendet werden.
Bei einer tiefen, nicht granulierenden Wunde können sogenannte Unterdruckverfahren angewendet werden. Diese Methode der Wundbehandlung ist schon seit den 80er-Jahren in den USA bekannt. Durch einen okklusiven Schaumstofffolienverband und eine Pumpe mit Sogwirkung können Ödem, Mikroorganismen und abgestorbenes Material abgeleitet werden. Zudem wird ein Unterdruck erzeugt, der die Bildung des Granulationsgewebes durch verstärkte Kapillareinsprossung und Stimulation der Wundheilungsprozesse anregt. Unterdrucktherapien können stationär wie auch ambulant durchgeführt werden.
Bei größeren Wunden ohne Epithelisierungstendenz und mit gut granulierendem Wundgrund kommen autologe Hauttransplantationen mittels Spalthaut oder Vollhaut infrage. Diese Methode ist mit größerem Aufwand (finanziell, Hospitalisation) verbunden, ist aber in vielen Fällen sehr effizient und reduziert oft auch die Schmerzen sehr effektiv.
Neuere lokale Wundbehandlungsmethoden
Neben den konventionellen Wundauflagen sind in letzter Zeit auch innovative Wundauflagen und Wundprodukte auf den Markt gekommen, welche besonders bei schwer heilenden Wunden zum Einsatz kommen:
Apligraf® ist ein autologes Hautersatzverfahren und besteht aus zwei Schichten lebender menschlicher Zellen. Die äußere Schicht besteht aus differenzierten Keratinozyten, die Innenschicht aus Fibroblasten in einer Kollagenmatrix. Die Zellen werden aus der menschlichen neonatalen Vorhaut gewonnen. Apligraf® wird auf chronischen Wunden angewendet, die trotz Therapie keine adäquate Heilungstendenz gezeigt haben. Am besten eignen sich Wunden mit Granulationsgewebe und fehlender Epithelisation. Durch Apligraf® wird die Wunde mit Zellen, Kollagenmatrix und anderen Proteinen versorgt, was die Wundheilung beschleunigen soll.
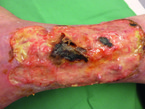
1 PRIMARY WOUND DRESSING® ist ein Wundspray aus Johanniskrautöl und Neemöl. Die Öle sollen die Wundheilung fördern und auch antimikrobiell wirken (Abb. 3). Zudem ist das Spray sehr einfach anzuwenden und das Öl verhindert das Verkleben der Wunde mit den Verbänden. Es sind erst wenige Studiendaten vorhanden, welche vor allem bei Verbrennungen oder postoperativen Wunden Erfolge zeigen konnten.
Sauerstoff spielt eine zentrale Rolle in der Wundheilung. In allen Stadien der Wundheilung wird er vermehrt benötigt, zudem führt eine Hypoxie zu einer Wundheilungsstörung. Mit verschiedenen Methoden hat man versucht, einer Wunde mehr Sauerstoff zur Verfügung zu stellen. Dazu gehören die lokale normobare und die systemische hyperbare Sauerstofftherapie, wobei nur die letztere eine Wirksamkeit zeigt. Dabei ergibt sich das Problem, dass bereits wenig Exsudat von der Wunde eine Diffusionsbarriere für den Sauerstoff darstellen kann. Granulox® ist ein wässriges Wundspray, das Hämoglobin aus Schweineblut als Sauerstofftransporter enthält. Dies hat den Vorteil, dass der Sauerstoff in der wässrigen Lösung gut zum Wundgrund diffundieren kann. Granulox® ist sehr einfach in der Anwendung: Das Spray wird alle zwei bis drei Tage auf die gereinigte Wunde aufgetragen und mit einer luftdurchlässigen Wundauflage abgedeckt. In klinischen Anwendungsstudien hat es bereits gute Resultate gezeigt, es bedarf jedoch noch weiterer Untersuchungen.
Genehmigter und bearbeiteter Nachdruck aus Schweizer Zeitschrift für Dermatologie und Ästhetische Medizin [medicos] 2/2014
Interessenkonflikte: Die Autorin hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2014; 36 (13) Seite 44-48