Ein Gestationsdiabetes ist hierzulande keine Seltenheit. Unter 1 000 Geburten werden 44 Fälle aufgedeckt. Darüber hinaus ist bei etwa 1 % der werdenden Mütter schon vor der Schwangerschaft ein Diabetes bekannt. Welche Gefahren drohen Mutter und Kind bei dieser Konstellation und wie kann der Hausarzt betroffene Patientinnen beraten?
Gemäß der jährlich erstellten Perinatalstatistik [5] wurde im Jahr 2012 bei 6 386 von 652 000 Geburten (entspricht knapp 1 %) ein vor der Schwangerschaft bekannter Diabetes der Mutter erfasst. Eine Differenzierung nach Typ-1- und Typ-2-Diabetes war nicht möglich, jedoch berichten Zentren über einen Anteil Typ-2-Diabetes von 20 – 40 %. Ein Gestationsdiabetes (GDM) lag bei 4,3 % der Geburten vor. Seit 2002 haben sich die Fälle mit präkonzeptionell bekanntem Diabetes verdoppelt und die mit Gestationsdiabetes verdreifacht.
Gewichtszunahme in der Schwangerschaft
Nach den Empfehlungen des Institute of Medicine (IOM) sollten Schwangere, abhängig von ihrem präkonzeptionellen BMI, bis zur Geburt nicht exzessiv an Gewicht zunehmen. Für eine Frau mit einem BMI von > 30 kg/m² ist eine obere Gewichtsgrenze von 9 kg prognostisch günstig, bei Typ-2-Diabetes bis 5 kg. Zwei Studien liefern neue Erkenntnisse. Eine irische Untersuchung fand eine exzessive Gewichtszunahme bei 59 % aller diabetischen Schwangeren, dies war mit signifikant erhöhten Risiken für Gestationshypertonie und Makrosomie bei Geburt assoziiert [4].
Eine exzessive Gewichtszunahme bei Schwangeren ist also nicht nur häufig, sondern mit spezifischen Risiken verbunden. Diabetischen Schwangeren wird daher empfohlen, sich einmal pro Woche selbst zu Hause zu wiegen und das Gewicht in Nomogrammen zu dokumentieren. So kann frühzeitig eine übermäßige Gewichtszunahme erkannt und modifiziert werden.
Teratogene Medikamente
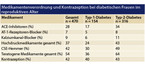
Eine englische, retrospektive Querschnittsanalyse von Krankenakten aus 22 Allgemeinarztpraxen von Frauen im Alter von 14 bis 49 Jahren hatte zum Ziel, die Verschreibung von potenziell teratogenen und für die Schwangerschaft nicht zugelassenen Medikamenten zu erfassen [7]. Die Ergebnisse für Frauen mit Typ-2-Diabetes zeigt Tabelle 1.
Danach ist die Verordnung von in der Schwangerschaft potenziell teratogenen Medikamenten bei Frauen mit Diabetes in der Reproduktionsphase häufig und nur unzureichend mit der notwendigen, sicheren Kontrazeption assoziiert. Hieraus ergeben sich folgende Konsequenzen:
- Regelmäßige Evaluation potenziell teratogener/fetotoxischer Medikamente (Antihypertensiva/CSE-Hemmer).
- Wenn solche Medikamente einwandfrei zur Reduktion des kardiovaskulären Risikos indiziert sind, sollte nachhaltig auf sichere Kontrazeption gedrängt werden.
- Bei Kinderwunsch: Tausch der RAS-Blocker gegen Alpha-Methyl-Dopa und Absetzen der CSE-Hemmer.
- Bei Unsicherheiten Konsultation einer Diabetes-Schwerpunkteinrichtung mit Erfahrung bei der Betreuung diabetischer Schwangerer.
Off-Label-Einsatz von Metformin
In den letzten Jahren wird Metformin „off Label“ von Gynäkologen zunehmend bei PCOS und unerfülltem Kinderwunsch, gelegentlich auch bei adipösen Frauen ohne Kinderwunsch als „Antiadipositum“ oder bei Diagnose einer „Insulinresistenz“ eingesetzt. Die US-amerikanische Endokrinologie-Gesellschaft hat hierzu eine evidenzbasierte Leitlinie nach dem GRADE-System vorgelegt [6]. Danach ist zunächst eine exakte Diagnose des PCOS nach den Rotterdam-Kriterien Voraussetzung für therapeutische Optionen.
Zusammenfassend ist Metformin nicht geeignet zur primären Therapie von Akne, Adipositas, Zyklusunregelmäßigkeiten oder zur Prävention von Schwangerschaftskomplikationen. Metformin hat keinen Einfluss auf die Abortrate, die Inzidenz von Präeklampsie, Frühgeburten oder Gestationsdiabetes. Trotz Verbesserung der Ovulationsrate steigert Metformin nicht die Rate von Lebendgeburten. Insulinresistenz – als Laborbefund oder klinisch vermutet– ist per se keine Krankheit und ebenfalls keine Metforminindikation.
Metformin wird bei Frauen mit PCOS als Zweitlinien-Medikament mit beschränktem Effekt eingeordnet. Daraus kann abgeleitet werden, dass Frauen mit Adipositas oder PCOS, aber ohne manifesten Diabetes deutlich zurückhaltender Metformin „off label“ verordnet werden sollte. Bei unerfülltem Kinderwunsch sollten keine übertriebenen Erwartungen mit Metformin verbunden werden und inadäquate Versprechungen hierzu unterbleiben.
Vitamin D und Schwangerschaft
Vitamin D erfreut sich seit einigen Jahren in verschiedenen medizinischen Spezialgebieten eines großen Publizitätsrummels („Hype“). Das hat auch vor dem Thema „Schwangerschaft“ nicht Halt gemacht. Inzwischen gibt es allerdings mehr Expertenmeinungen als eine hinreichend gesicherte Evidenzbasis. Es scheint daher wichtig, zunächst zwischen der reinen Supplementierung von Vitamin D („ist gut für die Schwangeren“) und einer Substitution von Vitamin D bei nachgewiesenem Mangel zu unterscheiden („Hypovitaminose D“). Leider gibt es keine international einheitliche Definition des Vitamin-D-Mangels in der Schwangerschaft.
Im Rahmen einer doppelblinden, randomisierten und plazebokontrollierten Studie mit gesunden, prämenopausalen Frauen wurde über zwölf Wochen 25 µg Vitamin D pro Tag versus Plazebo supplementiert [8]. Am Ende der Untersuchung bestanden keine Unterschiede beim Glukosestoffwechsel oder bei Parametern der Insulinresistenz.
Erniedrigte Vitamin-D-Spiegel (< 75 nmol/l für mütterliche und < 37,5 nmol/l für neonatale Endpunkte) scheinen dagegen mit erhöhten Risiken für GDM, Präeklampsie, bakterielle Vaginose und niedriges Geburtsgewicht assoziiert zu sein [1].
Nach diesen Studien ist eine generelle Vitamin-D-Supplementierung klinisch gesunder Frauen nicht erforderlich. Bei Frauen aus Hochrisikogruppen sollten Vitamin-D-Serumspiegel gemessen werden und bei nachgewiesenem Mangel substituiert werden. Zu diesen Hochrisikogruppen gehören Frauen:
- mit vegetarischer/veganer Kost
- mit unzureichender Sonnenlichtexposition (Leben in kalten Klimazonen/nördlichen Breitengraden)
- bei Verwendung von Sonnenschutz/UV-protektiver Kleidung (z. B. traditionelle Kleidung von Muslima)
- aus ethnischen Gruppen mit dunkler Hautfarbe.
Diabetische Nephropathie bei Schwangeren
Forscher der Universitätsfrauenklinik Kopenhagen untersuchten die Prävalenz der diabetischen Nephropathie und Mikroalbuminurie bei 220 Schwangeren mit Typ-2-Diabetes und 445 Schwangeren mit Typ-1-Diabetes [3]. Von den Schwangeren hatten 41 eine diabetische Nephropathie (Albumin-Kreatinin-Ratio > 300 mg/g) oder eine Mikroalbuminurie (Albumin-Kreatinin-Ratio 30 – 299 mg/g) bereits in der Frühschwangerschaft.
Die Prävalenzen der manifesten diabetischen Nephropathie waren mit 2,3 % bei Schwangeren mit Typ-2-Diabetes vergleichbar hoch wie bei Typ-1-Diabetes mit 2,5 %, ebenso die Prävalenzen der Mikroalbuminurie mit 4,5 vs. 3,4 %. Die Inzidenz der Präeklampsie war in beiden Gruppen bei manifester Nephropathie mit 40 bzw. 36 % und bei Mikroalbuminurie mit 10 bzw. 20 % beachtenswert hoch. Trotz im Mittel signifikant kürzerer Diabetesdauer (0,5 bis 13 vs. 10 bis 34 Jahre) sind Mikroalbuminurie und manifeste diabetische Nephropathie bei Typ-2- und Typ-1-Diabetes gleich häufig – ein Grund mehr, Schwangerschaften bei Typ-2-Diabetes sehr ernst zu nehmen. Diabetes und Blutdruck müssen adäquat eingestellt und das hohe Präeklampsierisiko beachtet werden.
Eiweißkonsum und Gestationsdiabetes
Eiweiß aus der täglich zugeführten Nahrung ist ein bedeutsamer Modulator des Glukosestoffwechsels. Es gibt nur wenige Erkenntnisse darüber, in welchem Ausmaß Nahrungsprotein das GDM-Risiko beeinflusst. In diese prospektive Kohortenstudie konnten 21 457 Einzelschwangerschaften der Nurses‘ Health Study II eingeschlossen werden [2].
Nach Korrektur für Alter, Parität, Lebensstilfaktoren und BMI zeigten sich beim Vergleich der höchsten mit der niedrigsten Quintile ein statistisch signifikant erhöhtes GDM-Risiko von 150 % für den Konsum tierischen Proteins und ein um 31 % erniedrigtes Risiko für den Konsum pflanzlicher Proteine. Die Substitution von 5 % der Kalorien aus tierischem Protein durch pflanzliches Protein reduzierte das GDM-Risiko um 51 %.
Für die hauptsächlichen Proteinquellen ergab sich ein doppelt so hohes GDM-Risiko für die Gesamtaufnahme roten Fleisches und ein um 27 % reduziertes Risiko für den Konsum von Nüssen. Hieraus können folgende gesundheitsfördernde Empfehlungen für Frauen im reproduktiven Alter abgeleitet werden:
- Genuss von tierischem Eiweiß einschränken, speziell von rotem Fleisch
- Mehr Nüsse, Geflügel, Fisch und Hülsenfrüchte essen.
Postpartale Blutglukosediagnostik
GDM wird heute als Prä-Typ-2-Diabetes eingeordnet. International einheitlich wird in Leitlinien ein erster oraler Glukosetoleranztest sechs bis zwölf Wochen postpartal empfohlen, weiterhin je nach Risiko alle ein bis drei Jahre. Bereits bis drei Monate nach der Geburt werden 20 bis 30 % Auffälligkeiten im Glukosestoffwechsel festgestellt, davon in ca. 75 % eine gestörte Glukosetoleranz (IGT) und in 25 % ein bereits manifester Diabetes. Innerhalb von acht bis zehn Jahren konvertieren 50 % der Frauen nach GDM in einen manifesten Diabetes. Andererseits können bei einer IGT durch intensive Lebensstiländerungen innerhalb von drei Jahren 50 % der Diabetes-Manifestationen verhindert werden. Daher ist die postpartale Nachsorge so wichtig.
Interessenkonflikte: Der Autor erklärt, Vortragshonorare von Berlin-Chemie AG und Novo Nordisk Pharma GmbH erhalten zu haben.
Erschienen in: Der Allgemeinarzt, 2014; 36 (11) Seite 50-52