Da mit dem 70. Lebensjahr das Senium beginnt, ist es möglicherweise korrekt, ab diesem Zeitpunkt von Menschen im fortgeschrittenen Alter zu sprechen. In dieser Altersgruppe leidet etwa ein Drittel der Bevölkerung an einer Arthrose. Etwa 6 % sind an einer Arthritis erkrankt, wobei die Calciumpyrophosphat-Dihydrat (CPPD)-Kristallarthropathie mit etwa 20 % die größte Gruppe der Arthritiden in dieser Altersgruppe darstellt. Auf die genannten Erkrankungen und im höheren Alter seltener auftretende entzündlich rheumatische Erkrankungen sowie auf nichtsteroidale Antirheumatika (NSAR) soll im folgenden Artikel eingegangen werden.
Arthrose
Die Arthrose ist eine degenerative Erkrankung des hyalinen Knorpels, bei der das Alter eine der wichtigsten prädisponierenden Faktoren darstellt [1].
Mit zunehmendem Alter kommt es durch den Verlust an Proteoglykanen zu einer Schädigung der hyalinen Knorpeloberfläche und nachfolgend zu einer Zerstörung der kollagenen Fasern.
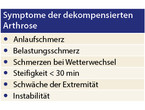
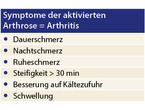
Die strukturellen Schäden können symptomlos bleiben (latente Arthrose). Treten typische Symptome auf, spricht man im deutschen Sprachraum entweder von einer dekompensierten (Übersicht 1) oder aktivierten Arthrose (Übersicht 2). Bei der dekompensierten Arthrose sind periartikuläre, außerhalb des Gelenkraumes befindliche Strukturen schmerzhaft verändert. Bei der aktivierten Arthrose kommt es zu einer Entzündung der Synovialis und damit zu einer typischen Arthritis.
Liegt eine latente Arthrose vor, spielen prophylaktische Maßnahmen wie Patientenschulung, normales Körpergewicht, Muskelkräftigung und Vermeidung von Überbelastungen eine bedeutende Rolle. Die Reduktion des Körpergewichts um 5 kg und ein Gehtraining führen zu einer Reduktion des Gonarthroserisikos um 50 % [2]. Ein regelmäßiges Fingertraining verbessert die Handfunktion ebenfalls signifikant [3]. Außerdem kann durch Taping die Gelenksstabilität erhöht und durch Einlagenversorgung der Verlust von hyalinem Knorpel an den Gelenken der unteren Extremitäten verzögert werden [4, 5].
Liegt eine dekompensierte Arthrose vor, sind lokale therapeutische Maßnahmen mit topischen nichtsteroidalen Antirheumatika (NSAR), Lokalanästhetika, Glukokortikoiden und physikalische Interventionen wie Phonophoresen wirksam. Aktive Bewegungstherapie und Thermotherapie tragen zur Muskeldetonisierung und Entlastung der Sehnen bei. Eine systemische analgetische Therapie mit Paracetamol und eventuell NSAR sollte nur ausnahmsweise erfolgen.
Bei aktivierter Arthrose sollte hingegen antiphlogistisch behandelt und eine intraartikuläre Glukokortikoidinjektion einer systemischen NSAR-Therapie vorgezogen werden.
Leider führen alle NSAR in Abhängigkeit von Dosis und Dauer der Einnahme zu einer erhöhten Rate an makrovaskulären Ereignissen [6, 7]. Da insbesondere Ibuprofen und Naproxen das Risiko für obere gastrointestinale Komplikationen um das Vierfache erhöhen [8] und Misoprostol eine protektive Wirkung auch am unteren Gastrointestinaltrakt und an der Niere entfaltet, sollte diese Substanz als "Magenschutz" im Alter bevorzugt eingesetzt werden [9, 10]. Wegen der im Alter abnehmenden Nierenfunktion führen NSAR im hypovolämischen Zustand gehäuft zu Ödemen, Hyperkaliämie und eventuell zum akuten Nierenversagen, sodass in dieser Patientengruppe neben einer ausreichenden Hydrierung eine Kontrolle der Nierenfunktion wichtig ist [11]. Außerdem sollten NSAR mit kurzer Halbwertszeit und hepatischer Ausscheidung bevorzugt werden.
Rheumatoide Arthritis
Die rheumatoide Arthritis (RA) des höheren Lebensalters unterscheidet sich von der RA im jüngeren Lebensalter vor allem durch eine oftmals hohe Krankheitsaktivität, den Befall großer Gelenke und durch Begleitmyopathien [12]. Diese Symptome und die oft wegen der vorhandenen Multimorbidität eingeschränkten Therapieoptionen führen zur raschen funktionellen Verschlechterung der Patienten. Ziel der Behandlung ist deshalb die rasche antiphlogistische Therapie mit Glukokortikoiden (12,5 bis 25 mg Prednisolonäquivalent/Tag) und NSAR sowie die rasche Mobilisierung der betroffenen Gelenke.
Bei Patienten mit geringer Krankheitsaktivität ist eine milde immunsuppressive Basistherapie mit Chloroquin bzw. Sulfasalazin oft ausreichend. Bei ungenügender Wirksamkeit hat Leflunomid gegenüber Methotrexat bei eingeschränkter Nierenfunktion den Vorteil einer geringeren Kumulation. Bei aggressiveren Krankheitsverläufen ist der Einsatz von Biologika (Etanercept, Abatacept etc.) trotz des erhöhten Infektionsrisikos eine große Hilfe [12].
RS3PE-Syndrom
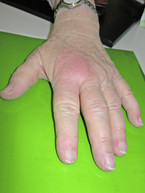
Diese Erkrankung, auch „remittierende seronegative symmetrische Synovitis mit Weichteilödemen (pitting edema)“ genannt, tritt bevorzugt bei älteren Männern auf und führt zu einer prallen Schwellung der Handrücken und zu Arthritiden der Hand- und Fingergelenke sowie selten der Ellbogen- und Schultergelenke mit deutlich pathologischen Entzündungszeichen (Abb. 1). Die Rheumafaktoren und Antikörper gegen citrullinierte Peptide sind typischerweise negativ. Das RS3PE-Syndrom ist manchmal als paraneoplastisches Phänomen vorhanden und gut mit mittleren Dosen von Glukokortikoiden und NSAR zu behandeln.
Kristallarthropathie
Die Calciumpyrophosphat-Dihydrat (CPPD)-Kristallarthropathie (früher Chondrocalcinose) ist eine typische Erkrankung des fortgeschrittenen Alters. Sie ist vor dem 50. Lebensjahr eine Rarität und bei über 85-jährigen Menschen in mehr als 25 % vorhanden. Die CPPD-Kristallarthropathie tritt entweder familiär gehäuft oder bei anderen metabolischen Erkrankungen wie Hyperparathyreoidismus, Hämochromatose oder Hypomagnesiämie auf.
Da die Ablagerung von CPPD-Kristallen im hyalinen Knorpel und im Faserknorpel zu degenerativen und entzündlichen Veränderungen führt, ist das Bild der CPPD-Kristallarthropathie vielfältig und reicht von asymptomatischen Zuständen über eine akute und chronische Arthritis bis zur Spondylitis. Werden CPPD-Kristalle in den Gelenkraum freigesetzt, führen sie über die Aktivierung des Inflammasoms zur Freisetzung von Interleukin-1.
Es entsteht meist eine Monarthritis an großen Gelenken, wobei in mehr als 50 % der Attacken das Kniegelenk befallen ist. Mit fallender Häufigkeit tritt die Arthritis auch in Hand-, Schulter-, Sprung- und Ellbogengelenken sowie in kleinen peripheren Gelenken auf (Abb. 2).
Die Arthritis erreicht ähnlich wie die akute Arthritis urica innerhalb von ein bis zwei Tagen ein Maximum und klingt nach ein bis drei Wochen spontan ab. Häufig ist sie von einer Rötung und manchmal auch von Fieber begleitet.
Die Diagnostik einer CPPD-Kristallarthropathie stützt sich auf die typische klinische Symptomatik, den Nachweis von CPPD-Kristallen in der Synovialflüssigkeit und den nativ-radiologischen oder sonographischen Nachweis von CPPD-Kristallen im hyalinen und Faserknorpel.
NSAR sind auch bei geriatrischen Patienten mit akuter CPPD-Kristallarthritis wegen der guten Wirksamkeit Therapeutika der ersten Wahl. Bei Kontraindikationen für eine Therapie mit NSAR werden Glukokortikoide intraartikulär und systemisch verordnet. Eine Dauertherapie mit Colchicin oder niedrig dosierten NSAR reduziert die Häufigkeit von wiederholten akuten CPPD-Kristallarthritiden.
Arthritis urica (Gicht)
Die Prävalenz der Arthritis urica liegt in der Bevölkerung bei etwa 1 – 2 %. Sie hat in den letzten Jahrzehnten insbesondere im Alter stark zugenommen [13].Ursachen dafür scheinen die mit dem Alter zunehmende Niereninsuffizienz, der gehäufte Einsatz von Thiaziddiuretika und der gesteigerte Wohlstand mit Zufuhr von Zuckerersatzstoffen auch bei älteren Menschen zu sein.
Klinisch sind die Gichtattacken bei älteren Menschen oft relativ schmerzarme mono- oder oligoartikuläre Arthritiden ohne Rötung mit Befall der Knie- und Sprunggelenke und manchmal auch der Fingergelenke sowie von Bursen.
Die Diagnose kann dann nur durch die Anamnese einer attackenförmigen Arthritis und den Harnsäurekristallnachweis im Gelenkpunktat gestellt werden. Mit großer Sicherheit deuten auch das sonographische Doppelkonturphänomen im hyalinen Knorpel und das Sternenhimmelphänomen in der Synovialis sowie im periartikulären Gewebe als Ausdruck von Gichttophi auf eine Arthritis urica hin.
Therapeutisch wird die akute Arthritis urica im Alter wegen der eingeschränkten Nierenfunktion oft mit Glukokortikoiden intraartikulär oder systemisch behandelt. Alternativ können bei eingeschränkter Nierenfunktion auch Colchicin in niedriger Dosis (z. B. 1,2 – 1,6 mg/d, CAVE: Diarrhoe) oder NSAR unter Kontrolle der Nierenfunktion und der Elektrolyte versucht werden. Nach dem akuten Gichtanfall sollte unbedingt unter monatlichen Kontrollen die Serumharnsäurekonzentration durch die Gabe von Urikostatika und durch eine purinarme Kost auf Dauer unter einen Schwellenwert von 6 mg/dl gesenkt werden. Bei eingeschränkter Nierenfunktion oder Unverträglichkeit von Allopurinol steht nun Febuxostat als weitere urikostatische Substanz zur Verfügung.
Polymyalgia rheumatica und Riesenzellarteriitis
Polymyalgia rheumatica (PMR) und Riesenzellarteriitis sind typische entzündliche Systemerkrankungen im Alter.
Die PMR tritt in mehr als 90 % der Fälle nach dem 60. Lebensjahr auf und manifestiert sich mit Allgemeinsymptomen, mit starken, symmetrisch im Schulter- und Hüftgürtelbereich auftretenden muskulären Schmerzen mit nächtlichem Erwachen, die sich bei Bewegung deutlich verstärken und mit einer starken Steifigkeit nachts und morgens einhergehen [12]. Typischerweise ist die passive Untersuchung des Schulter- und Hüftgürtels unauffällig. Sonographisch finden sich häufig Bursitiden subacromial und peritrochanter und laborchemisch pathologische Entzündungsparameter.
Bei etwa einem Drittel der Patienten liegt der PMR eine Riesenzellvaskulitis zugrunde, die sich durch zusätzliche Sehstörungen, Kauschmerzen, temporale Kopfschmerzen oder Ischämien des Auges (CAVE: irreversible Amaurosis), des Darmes oder der Extremitäten bemerkbar machen kann.
Die Diagnose der PMR ist eine reine Ausschlussdiagnose, da kein spezifischer diagnostischer Test zur Verfügung steht. Die Diagnose einer Riesenzellvaskulitis wird durch das Halo-Phänomen in der Sonographie der supraaortalen Gefäße, durch die Ergebnisse der PET-CT-Untersuchung und der MR-Angiographie erhärtet und durch die Temporalisbiopsie gesichert.
Therapeutisch werden sowohl die PMR als auch die Riesenzellvaskulitis mit Glukokortikoiden behandelt. Bei der PMR ist eine Anfangsdosis von 20 bis 25 mg Prednisolonäquivalent pro Tag ausreichend, bei der Riesenzellarteriitis ist eine Anfangsdosis von 1 mg/kg/d erforderlich. Bei der PMR muss mit einer Therapiedauer von ein bis vier Jahren gerechnet werden, bei der Riesenzellarteriitis ist eine Glukokortikoidtherapie – zumindest in niedriger Dosis – meist lebenslang erforderlich.
Oft kann eine niedrige Glukokortikoiddosis nur durch eine zusätzliche immunsuppressive Therapie mit Methotrexat oder Azathioprin erreicht werden. Die erforderliche Glukokortikoiddosis führt jedoch besonders bei älteren Menschen oft zu einer Manifestation oder Verschlechterung eines Typ-2-Diabetes, zu hypertonen Blutdruckwerten, zu Hypokaliämien, psychischen Veränderungen bis zur Verwirrtheit und zu einer verstärkten Anfälligkeit für bakterielle Infekte und Herpes zoster. Außerdem führt der steroidinduzierte Knochenverlust zu einer verstärkten Frakturneigung, weshalb eine ausreichende Kalzium- und Vitamin-D-Zufuhr erfolgen sollte.
Interessenkonflikte: keine deklariert
Erschienen in: Der Allgemeinarzt, 2014; 36 (11) Seite 14-18