Diese Fortbildung gibt ein Update zur Pathophysiologie und den aktualisierten Behandlungsempfehlungen der diabetischen Retinopathie. Die ophthalmologische Therapie erlaubt es meist, den Befund der jeweiligen Stadien zu stabilisieren. Vielfach können sogar relevante Sehverbesserungen erreicht werden, insbesondere dank neuer Therapieoptionen für die Behandlung des diabetischen Makulaödems als wichtigster Erblindungsursache. Früherkennung und funktionierende Kooperation zwischen Hausarzt/ Internist/Diabetologe und Augenarzt erlauben es, die Prognose und Lebensqualität der betroffenen Patienten signifikant zu verbessern.
Diabetische Retinopathie: häufig und gefürchtet
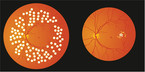
Die diabetische Retinopathie ist die häufigste mikrovaskuläre Komplikation des Diabetes mellitus. Parallel zur steigenden Prävalenz des Diabetes sind auch die okulären Folgekomplikationen angestiegen. Bei über 90 % der Menschen mit Typ-1-Diabetes sind nach 25 Erkrankungsjahren Veränderungen einer Retinopathie vorhanden (Abb. 2). Die häufigste Ursache einer ausgeprägten Sehverschlechterung oder einer Erblindung infolge eines Diabetes ist das Makulaödem [16]. 25 – 30 % der Menschen mit Typ-2-Diabetes sind in der Altersgruppe der über 70-Jährigen hiervon betroffen [9]. Ein Drittel leidet bereits zum Zeitpunkt der Diagnose eines Typ-2-Diabetes an einer diabetischen Retinopathie, nach einer Manifestationsdauer von 15 bis 20 Jahren beträgt der Anteil dann bis zu 80 % [17]. In 10 – 30 % der Fälle entwickelt sich bis zu diesem Zeitpunkt bereits eine proliferative Retinopathie. Komplikationen der proliferativen diabetischen Retinopathie mit Blutungen in den Glaskörperraum sowie traktiven Proliferations-Membranen machen bei immerhin 3 % des Typ-1-Diabetes eine vitreoretinale Operation nach zehn Jahren erforderlich [3].
Obwohl für die Betroffenen die Sorge vor einer Sehverschlechterung gegenüber den anderen Diabetes-Komplikationen deutlich im Vordergrund steht [1], ist diese Komplikation mit ihren pathophysiologischen Zusammenhängen – das Auftreten und die Progression der Retinopathie hängen unmittelbar von der Güte insbesondere der Blutzucker- und Blutdruckeinstellung ab – kaum Inhalt aktueller Schulungsprogramme. Hinzu kommt auch, dass Informationen über die neueren Therapieoptionen der diabetischen Retinopathie/Makulopathie noch viel zu wenig über die ophthalmologischen Fachkreise hinaus verbreitet sind. Für eine bessere Kooperation der unterschiedlichen Fachdisziplinen sind aber ein besserer Austausch und das Wissen um die aktuellen Behandlungsstandards essenziell.
Nicht-proliferative diabetische Retinopathie
Neben bereits frühzeitig nachweisbaren neurodegenerativen Veränderungen steht die Schädigung der Gefäßwand retinaler Kapillaren im Vordergrund. Über verschiedene Mechanismen führt die Hyperglykämie unter anderem zur Schädigung des Endothels, einem Verlust von Perizyten und Veränderungen an der Gefäßbasalmembran. Auch durch die gleichzeitige Freisetzung verschiedener Mediatoren kommt es zu Störungen der Mikroperfusion mit Mikrothrombosierungen und einem lokalen Zusammenbruch der Blut-Netzhaut-Schranke. Im Gegensatz zu mikrovaskulären Schädigungen an anderen Organen können Augenärzte diese mikrovaskulären Schäden der Netzhautgefäße direkt ophthalmoskopisch unter anderem anhand von Mikroaneurysmen, Blutungen sowie dem Austritt von Exsudaten erkennen (Abb. 3). Weißlich imponierende retinale Lipidablagerungen werden als harte Exsudate bezeichnet, die häufig ein retinales Ödem begleiten.
Der Austritt von Flüssigkeit aus den Netzhautgefäßen kann an der entstehenden lokalen Verdickung der Netzhaut erkannt werden. Ein Netzhautödem ist mit Hilfe der optischen Kohärenztomographie (OCT) exakt zu quantifizieren. Das intra- und extrazelluläre Ödem führt seinerseits unter anderem durch die wachsende Diffusionsbarriere auch zu einer Minderversorgung mit Sauerstoff und Metaboliten und so zu einer Schädigung retinaler Photorezeptoren und Nervenzellen.
Kommt es im weiteren Verlauf zu einer Zunahme der diabetogenen Veränderungen an der gesamten Netzhaut im Sinne einer schweren prä-proliferativen Retinopathie, so ist dies klinisch an einer Zunahme von retinalen Blutungen an der gesamten Netzhaut sowie an perlschnurartigen Venenwandveränderungen und mikrovaskulären, knospenartigen Gefäßveränderungen im Netzhautniveau (intraretinale mikrovaskuläre Anomalie [IRMA]) zu erkennen. Es droht bei diesen Anzeichen ein baldiger Übergang in das proliferative Stadium der Retinopathie. Um Komplikationen einer fortschreitenden, generalisierten retinalen Ischämie zu verhindern, kann eine flächige, sogenannte "panretinale" Laserbehandlung mit Zerstörung der betroffenen (mittel-)peripheren Netzhaut das Sauerstoffangebot für das übrige Gewebe verbessern. Leider bemerken die Betroffenen infolge dieser Therapie eine gewisse Einschränkung des Gesichtsfelds. Gleichzeitig leiden sie unter den mit der Lasertherapie einhergehenden Störungen des Dämmerungssehvermögens und vermehrter Blendungsempfindlichkeit. Diese Nachteile müssen in Kauf genommen werden, um die im Folgenden beschriebenen schweren Komplikationen einer proliferativen Retinopathie zu vermeiden. Die Kontrollintervalle müssen nach Maßgabe des Augenarztes an das jeweilige Stadium der Retinopathie angepasst werden, um eine zeitgerechte, stadienadaptierte Therapie durchführen zu können (Tabelle 1). Dies ist besonders wichtig, da die Patienten meist erst mit Auftreten von Komplikationen und damit in fortgeschrittenen Stadien selbst auf die Netzhautveränderungen aufmerksam werden. Zuweilen ist dann aber bereits die Sehkraft irreversibel beeinträchtigt.
Proliferative diabetische Retinopathie
Unter anderem trägt die lokale Unterversorgung der Netzhaut mit Sauerstoff zur Freisetzung verschiedener Wachstumsfaktoren bei. Der vaskuläre endotheliale Wachstumsfaktor VEGF (vascular endothelial growth factor) ist ein Schlüsselfaktor für Krankheitsentstehung sowie Voranschreiten sowohl der diabetischen Retinopathie wie auch der diabetischen Makulopathie [21, 8]. Einerseits führt seine Wirkung auf die Gefäßpermeabilität zum Austritt von Flüssigkeit und Exsudaten in die zentrale Netzhaut und ist somit eine wesentliche Ursache für das Makulaödem.
Andererseits ist der Faktor auch ein wesentlicher Auslöser von Gefäßproliferationen, in deren Folge es zu schweren Einblutungen in das Auge sowie einer traktiven Ablösung der Netzhaut oder einem Einwachsen von Gefäßen in den Bereich des Kammerwinkels kommen kann. Letzteres kann zu Augendruckanstieg im Sinne eines (Sekundär-) Glaukoms („grüner Star“) führen mit entsprechender Schädigung des Sehnerven [5]. In diesen Spätstadien droht eine schnelle Erblindung.
Makulopathie und Makulaödem – was nimmt der Patient wahr?
Die zentrale Netzhaut ist für die Sehfunktion von herausragender Bedeutung, weil hier die Rezeptordichte und damit die Auflösung am größten sind. Durch Fixation, also explorative Augen- und Kopfbewegungen, wird den Augengesunden meist nicht bewusst, dass ein hochauflösendes, scharfes Sehen nur im zentralen Gesichtsfeld möglich ist (vgl. Abb. 1). Ist aber die zentrale Netzhaut in einem Bereich von 4° beispielsweise durch ein diabetisches Makulaödem geschädigt, so kann eine Sehkraft von 0,4 (Leseschwelle) ohne vergrößernde Sehhilfen in der Regel nicht mehr erreicht werden. Die extrazelluläre Flüssigkeitsansammlung kann sich in einer Verschlechterung der Auflösung sowie Verzerrungen oder einem „Welligsehen“ (sog. Metamorph-
opsien) äußern. Weil die einzelnen Photorezeptoren auseinandergebogen werden, erscheint das Bild dabei ungleichmäßig teilweise vergrößert und in benachbarten Gebieten verkleinert (Abb. 1). Auch wenn die Schädigung der zentralen Netzhaut durch Ischämie oder Ödem eine sehr häufige Erblindungsursache ist, bemerken die Patienten typischerweise trotz Voranschreiten der Retinopathie zunächst lange Zeit nichts [17]. Selbst wenn der Augenarzt schon Exsudate, Ödeme oder Punktblutungen in der zentralen Netzhaut erkennen kann, bleibt die Progression meist für den Patienten noch unbemerkt. Durch Gewöhnungseffekte wird das langsame Eintreten einer Sehverschlechterung zusätzlich später wahrgenommen. Typischerweise beobachten Patienten auch vorübergehendes Verschwommensehen, wenn Schwankungen der Linsenbrechkraft aufgrund der Blutzuckerschwankungen auftreten. Auch die Fähigkeit jüngerer Menschen, Folgen geringer Netzhautverdickungen durch Akkommodation noch ausgleichen zu können, spielt hier eine Rolle. Phänomene, die auf ein Makulaödem hindeuten:
- Schwankungen der zentralen Sehschärfe (Nebel, Verschwommensehen, Verzerrtsehen),
- nicht korrigierbare Verschlechterungen der Sehschärfe,
- Abnahme der Farbintensität.
Hinweise auf eine ausgeprägte periphere Retinopathie im Proliferationsstadium oder beginnende Netzhautablösung sind:
- Lichtblitze verbunden mit oder unabhängig von Augenbewegungen bei Zug an der Netzhaut,
- Rußregen durch eine Einblutung in den Glaskörperraum,
- Schatten oder Schleier von außen [1].
Die Beschwerden sind in der Regel nicht schmerzhaft [9]. Der progrediente Verlust der Sehkraft führt häufig zu erheblichen Einschränkungen im Alltag, verbunden mit entsprechender Verminderung der Lebensqualität [10]. Das Risiko für einen Verlust der Sehkraft kann durch eine frühzeitige und effektive Kontrolle insbesondere des Blutzuckers und des Blutdrucks neben weiteren unten genannten Risikofaktoren sowie mit einer stadiengerechten Therapie der Netzhautveränderungen reduziert werden. Beginnende Veränderungen der Netzhaut zeigen zudem ein erhöhtes Risiko für eine diabetische Nephropathie an. Umgekehrt ist eine manifeste Nephropathie oft mit rascherer Progredienz einer Retinopathie verbunden. Leider geben sowohl Makulaödem als auch periphere Retinopathie gleichzeitig Hinweise auf eine erhöhte Mortalität [2]. Daher sind die Informationen über Ausmaß und Progredienz der Netzhautveränderungen als Hinweise auf das generelle mikrovaskuläre und makrovaskuläre Komplikationsrisiko des Betroffenen wichtig für die hausärztliche und diabetologische Führung des Patienten.
Diagnostik und Diagnose
In der Nationalen Versorgungsleitlinie Typ-2-Diabetes wird zum Screening der Retinopathie eine standardisierte augenärztliche Untersuchung empfohlen (vgl. Tabelle 1). Zusätzlich sind besondere Lebensumstände des Patienten zu bedenken, die ein besonders hohes Risiko der Entstehung/Progredienz einer diabetischen Retinopathie beinhalten: So wird bei Schwangerschaft und Diabetes ein 3-monatliches Screening empfohlen. Auch in der Blutzucker-Neueinstellungsphase, gerade wenn der Blutzucker bei hohen Langzeitwerten (HbA1c) stark gesenkt werden muss, ist aufgrund des erhöhten Risikos einer Zunahme der Retinopathie eine engmaschige Beobachtung angeraten. Insbesondere wenn bereits eine diabetische Retinopathie besteht, verkürzen sich die Kontrollintervalle.
Zur Evaluierung der diabetischen Retinopathie ist die detaillierte Erfassung des gesamten Augenhintergrunds von Bedeutung. Mit der binokularen Ophthalmoskopie (Spiegelung des Augenhintergrunds) unter Weitstellung der Pupille ist eine stereoskopische Bewertung möglich [15]. Da hierfür eine Erweiterung der Pupille erforderlich ist, sollte der Patient nicht mit dem eigenen PKW zur Untersuchung kommen, denn durch die Pupillenweitstellung ist über Stunden eine Teilnahme am Straßenverkehr nach der Untersuchung nicht möglich.
Als Zusatzuntersuchung erlaubt es die Fluoreszenzangiographie, die Schädigung der retinalen Gefäße noch exakter zu erkennen. So ist sie besonders hilfreich für das Erkennen retinaler Ischämie (Minderdurchblutung) [15, 23]. Die Optische Kohärenztomographie (SD-OCT) liefert hochauflösende dreidimensionale Bilder der Netzhaut. Mit diesem Untersuchungsverfahren können die Netzhautdicke und intraretinale Flüssigkeit exakt quantifiziert werden. Daher ist diese nicht-invasive Untersuchung enorm wichtig für die Verlaufskontrolle im Rahmen einer Behandlung des diabetischen Makulaödems. Wenn eine irreversible Schädigung oder Atrophie besteht, wird dies an einer starken Verdünnung und Schädigung der Netzhautschichten sichtbar. Auch eine Traktion der zentralen Netzhaut z. B. durch Proliferationsmembranen und damit eine mögliche Operationsindikation kann mit der OCT identifiziert werden.
Kontrolle von Risikofaktoren
Hausarzt und Diabetologe haben einen großen Einfluss, die Progression der Retinopathie zu verhindern und eine Erblindung zu vermeiden. Ein frühzeitiges Management der Hauptrisikofaktoren, insbesondere der Blutzuckereinstellung und des Blutdrucks, wie aber auch die Therapie einer Hyperlipidämie sind dabei essenziell [7].
Bei der Einstellung des Blutzuckers ist gemäß den Leitlinien besonders das Risiko einer damit assoziierten möglichen Zunahme der Retinopathie („early worsening“ der Retinopathie) bei rascher ausgeprägter Blutzuckerabsenkung zu bedenken, insbesondere wenn bereits eine Retinopathie vorbesteht. Auch gilt es, trotz des Zieles einer guten Blutzuckereinstellung andererseits Hypoglykämien zu vermeiden, insbesondere bei älteren Menschen [17].
Die aktualisierten Leitlinien der Europäischen Gesellschaft für Hypertonie (ESH) empfehlen Blutdruck-Zielwerte von unter 140/90 mmHg [18]. In der Early Treatment Diabetic Retinopathy Study hat sich gezeigt, dass erhöhte Blutfettwerte bei einer diabetischen Retinopathie mit einem erhöhten Risiko für ein Makulaödem verbunden sind [24]. Für die Normalisierung der Lipide scheinen Fibrate einen günstigen Effekt zu haben, der in der FIELD Study beobachtet wurde [13]. Die positive Wirkung auf die diabetische Retinopathie bei Typ-2-Diabetes führte kürzlich zur Zulassung von Fenofibrat als unterstützende Therapie einer diabetischen Retinopathie in Australien. Regelmäßige Bewegung und Gewichtskontrolle mit Nikotinkarenz können das Risiko für eine Retinopathie bei Hochrisikopatienten um bis zu 50 % reduzieren [9].
Ophthalmologische Therapie
Die ophthalmologische Behandlung sollte so früh wie möglich erfolgen, weil die Schädigung nach einer gewissen Zeit oftmals irreversibel ist. Deshalb ist das regelmäßige ophthalmologische Screening auch so entscheidend.
Laserkoagulation
Früher stand zur Verhinderung von Komplikationen und Krankheitsprogression allein die Laserkoagulation zur Verfügung. Unterschieden werden muss grundsätzlich die flächige, sogenannte panretinale Laserung der Peripherie zur Kontrolle der peripheren Retinopathie von der fokalen Laserkoagulation (Abb. 4). Erstere erfordert die Applikation zahlreicher Koagulationseffekte im Bereich der gesamten Netzhautperipherie und wird teilweise als schmerzhaft empfunden. Diese Therapie erfolgt meist in mehreren Sitzungen.
Die Behandlung des Zentrums (Makula) geht hingegen mit deutlich weniger und kleineren Herden geringerer Energie einher. Diese Behandlung ist schmerzfrei. Die fokale Laserkoagulation kann meist nur eine Stabilisierung der diabetischen Makulopathie erreichen. Das Risiko eines weiteren Sehverlustes wird damit um etwa 50 % reduziert [7, 9].
Intravitreale operative Medikamentenapplikation: VEGF-Inhibitoren
Medikamentöse Ansätze vermeiden die thermische Destruktion, die mit einer Laserbehandlung verbunden ist. Die Behandlung mit Hemmern des Wachstumsfaktors VEGF (vascular endothelial growth factor) ermöglicht bei über 30 % der Patienten mit einem das Sehvermögen beeinträchtigenden Makulaödem das Erreichen einer Sehverbesserung um mehr als drei Zeilen (Abb. 5). Um dieses Ziel zu erreichen, sind allerdings im Mittel über sieben Behandlungen während des ersten Jahres erforderlich.
In der Restore-Extensionsstudie (Open-label) zeigt sich, dass die Anzahl der notwendigen Injektionen im Verlauf der Behandlung (2. und 3. Behandlungsjahr) mit drei bis vier bzw. zwei bis drei Injektionen/Jahr deutlich abnimmt. Trotz dieser abnehmenden Wiederbehandlungsfrequenz konnte die Visusverbesserung in einer durchgeführten Studie über drei Jahre weiter aufrechterhalten werden [20].
Nach intensiver Betäubung der Augenoberfläche mittels Lokalanästhetika wird das Medikament in den Glaskörperraum gespritzt (Abb. 6). Das Infektionsrisiko bei der invasiven Therapie ist erfreulicherweise sehr gering (< 0,05 %) und auch durch Diabetes in Studien gegenüber vergleichbaren Injektionstherapien zum Beispiel bei exsudativer Makuladegeneration nicht erhöht gewesen. Wenn es jedoch zur Entzündung des Augeninneren (End-
ophthalmitis) aufgrund einer okulären Injektion kommt, so droht meist eine dramatische, bleibende Sehbeeinträchtigung oder schlimmstenfalls der Verlust des Auges. Deshalb muss die operative Medikamenteneingabe unter den sterilen Bedingungen eines OPs erfolgen.
Ranibizumab
Ranibizumab (Lucentis®) ist seit Anfang 2011 für die Behandlung eines diabetischen Makulaödems mit fovealer Beteiligung zugelassen. Der Wirkstoff ist ein humanisiertes, rekombinantes monoklonales Antikörperfragment (Fab) ohne Fc-Anteil, das alle biologisch aktiven Isoformen von VEGF-A hemmt [4]. Unter Ranibizumab wurde eine rasche Verbesserung der Sehkraft beobachtet (Abb. 7) [19]. Um den maximalen Therapieeffekt einer Anti-VEGF-Therapie auch zu erreichen und die Therapie adäquat steuern zu können, empfehlen die Fachgesellschaften zunächst vierwöchentliche Kontrollen mit OCT-Untersuchung. Weitere Anti-VEGF-Präparate sind bislang nur Off-Label in Benutzung oder befinden sich noch in der Zulassungsphase.
Steroide
Gemäß der Stellungnahme der Fachgesellschaften sind Steroidderivate wegen der damit verbundenen häufigeren lokalen Nebenwirkungen in Form von Augendruckanstiegen (Glaukominduktion) und Kataraktförderung als Therapie der 2. Wahl bestimmten Sondersituationen vorbehalten, insbesondere den Fällen mit Makulaödem, die auf Laser- und Anti-VEGF-Therapie nicht ansprechen.
Das Implantat Iluvien® setzt Fluocinolon über bis zu drei Jahre im Auge frei. Der Wirkstoff führt in nahezu allen Fällen zu einer Trübung der Linse und in fast 40 % der Fälle zu einem Anstieg des Augendrucks. Selbst wenn nur Patienten ohne ein erhöhtes Glaukom-Risiko behandelt werden, wurde in Studien in fast 6 % der Fälle eine drucksenkende Augenoperation erforderlich. Daher ist der Einsatz dieser Therapieoption sorgfältig abzuwägen [25].
Vitrektomie
Eine Operation des Glaskörpers bleibt schweren Komplikationen wie proliferativen Veränderungen und hartnäckigen Einblutungen in den Glaskörperraum vorbehalten [7, 9]. Hier kommt nicht selten Silikonöl als temporäre Tamponade zum Einsatz. Selten macht eine Glaskörperoperation auch Sinn, wenn eine Membran oder der Glaskörper an der zentralen Netzhaut zieht und diese dadurch schädigt.
Chance zur Interaktion und Intervention: Screening-Untersuchung
Da die Schädigung der Netzhaut in frühen bis mäßigen Stadien oft symptomlos verläuft, suchen viele Patienten den Arzt erst auf, nachdem die Sehkraft bereits nachgelassen hat und das Komplikationsstadium der diabetischen Retinopathie eingetreten ist. Um dies zu verhindern, sind regelmäßiges augenärztliches Screening und frühzeitige stadiengerechte Therapie sowie rechtzeitige Korrektur der genannten Risikofaktoren entscheidend. Dazu ist eine gute Zusammenarbeit zwischen Hausarzt, Diabetologe, Augenarzt und Patient/Patientenverbänden erforderlich.
Die erste augenärztliche Untersuchung bezüglich einer Retinopathie soll bereits bei der Diagnose des Typ-2-Diabetes erfolgen, da wegen der unsicheren Erstmanifestation bereits zu diesem Zeitpunkt bei einem Teil der Patienten mit Netzhautfolgeschäden zu rechnen ist.
Prävention: Vielen Patienten ist nicht bewusst, in welchem Ausmaß sie selbst zur Prävention diabetischer Folgeschäden wie der diabetischen Retinopathie beitragen können. In der Nationalen Versorgungsleitlinie zum Typ-2-Diabetes wird empfohlen, die Patienten im Rahmen von Diabetes-Schulungen über die Gefahren der Netzhautschädigungen und die Bedeutung regelmäßiger Untersuchungen beim Hausarzt und beim Augenarzt zu informieren [9]. Tatsächlich ist die Retinopathie leider bisher in viel zu geringem Umfang Inhalt von Schulungsveranstaltungen. Um eine gute Compliance bezüglich der augenärztlichen Diagnostik und Behandlung zu unterstützen, sollten Patient und Hausarzt über Ursachen und Verlauf der diabetischen Retinopathie sowie deren Prophylaxe und moderne Therapieoptionen informiert sein.
Interdisziplinäre Befundkommunikation: Infolge der Summation der Risikofaktoren steigt mit zunehmender Diabetes-Erkrankungsdauer das Risiko einer diabetischen Retinopathie, sodass der Prophylaxe für die Langzeitprognose ein entscheidender Einfluss zukommt, aber gleichzeitig regelmäßige Netzhautkontrollen selbst bei optimaler Risikofaktoreinstellung erforderlich bleiben.
Die augenärztliche Untersuchung sollte am besten mit einem standardisierten Bogen dokumentiert werden, der dem Hausarzt/Diabetologen Auskunft über Ausmaß und mögliche Progredienz der diabetischen Retinopathie gibt. Auf dem augenfachärztlichen Untersuchungsbogen der „Initiativgruppe Früherkennung diabetischer Augenerkrankungen“ (IFdA, www.diabetes-auge.de – Ärzte – AU-Bogen) können einerseits vom Hausarzt oder Diabetologen für den Augenarzt folgende Informationen vermerkt werden: der Diabetestyp, der HbA1c-Wert, die Diabetesdauer sowie das Vorliegen einer Hypertonie oder Nephropathie.
Umgekehrt erlaubt der Bogen dem Augenarzt die exakte Dokumentation der Fundusbefunde (z. B. Mikroaneurysmen, Glaskörpereinblutungen etc.) und des Retinopathiestadiums. Wird eine Retinopathie festgestellt, entscheidet der Augenarzt, in welchen Abständen Kontrollen folgen sollen oder welche Therapie gewählt wird [9]. Auch dies wird auf dem Augendiagnostikbogen vermerkt und mitgeteilt.
Bei Menschen mit Typ-1-Diabetes sollte die erste Untersuchung der Augen spätestens nach fünf Jahren bzw. mit Eintritt der Pubertät erstmals vorgenommen werden [16]. Wie bereits erwähnt, sollte in der Schwangerschaft und kurz nach Entbindung ein maximal dreimonatiger Abstand der Augenuntersuchung nicht überschritten werden, weil das Progressionsrisiko, ähnlich wie bei der Neueinstellung eines zuvor schlecht eingestellten Diabetes, stark erhöht ist. Am häufigsten wird eine Verschlechterung allerdings nach der Entbindung beobachtet.
Es ist wichtig, die Patienten auf diese Risikosituationen ebenso hinzuweisen wie den behandelnden Augenarzt. Umgekehrt sollte der behandelnde Diabetologe über Ausmaß und Progredienz der Retinopathie informiert sein, einerseits um entsprechend seine Therapiemaßnahmen abzustimmen, andererseits liefert die exakte Information über die diabetischen Folgeschäden an der Netzhaut wichtige Hinweise für das kardiovaskuläre Risiko und die Morbidität des betroffenen Patienten insgesamt.
Krankheitsbewusstsein: Eine Selbstuntersuchung mit dem sogenannten Amsler-Gitter bietet dem Patienten zusätzlich die Möglichkeit, Verzerrungen (Metamorphopsien) und Einschränkungen des zentralen Gesichtsfelds früher eigenständig zu erkennen [6]. Für diesen einfachen Test ist eine Seiten-getrennte Kontrolle wichtig, indem ein Auge wechselseitig abgedeckt wird. Finden sich Veränderungen, ist eine zeitnahe Augenuntersuchung angeraten.
Kooperation zwischen Hausarzt und Augenarzt
Dem Hausarzt/Diabetologen kommt als Ansprechpartner der Patienten eine Schlüsselrolle zu. Seine wichtigste Aufgabe besteht einerseits darin, in Zusammenarbeit mit dem Patienten immer wieder auf Einstellung von Blutzucker und Blutdruck zu achten und zu regelmäßiger Bewegung zu motivieren. Damit kann in günstigen Fällen das Auftreten der diabetischen Retinopathie verhindert werden.
Andererseits koordiniert der Hausarzt die Kontrollen und Behandlungen anderer Fachdisziplinen. Auch kann er die Informationen über Stand und Progredienz einer diabetischen Retinopathie als Hinweis für weitere mikro- und makrovaskuläre Folgekomplikationen werten und zum Monitoring des Patienten in seinem Krankheitsverlauf nutzen.
Den Patienten muss klargemacht werden, dass bei rechtzeitiger Erkennung einer diabetischen Retinopathie heutzutage viele Therapieoptionen bestehen, um das Sehvermögen zu erhalten. Dabei ist darauf hinzuweisen, dass am Anfang einer Injektionstherapie eine konsequente Wiederbehandlung und häufige Kontrolluntersuchungen erforderlich sind und dass eine Injektionsbehandlung ohne Risikofaktoreinstellung langfristig nicht erfolgreich sein kann.
Auf unserem CME-Portal www.med-etraining.de können Sie u. a. auch diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Der Allgemeinarzt, 2014; 36 (5) Seite 58-64