In Deutschland sind schätzungsweise bis zu 600 000 Menschen mit dem Hepatitis-B-Virus und bis zu 800 000 mit dem Hepatitis-C-Virus infiziert. Die Dunkelziffer nicht erkannter infektiöser Hepatitiden ist hoch. Unbehandelt droht jedoch schlimmstenfalls eine Leberzirrhose oder ein hepatozelluläres Karzinom. Davon abgesehen können die Viren weiterverbreitet werden. Daher sollte bei allen Patienten mit erhöhten Leberwerten nach einer Hepatitis gefahndet werden. Die Serologie der verschiedenen Hepatitis-Formen von A bis E soll im folgenden Beitrag rekapituliert und die jeweiligen Tücken beleuchtet werden.
Im Gegensatz zu den vorwiegend auf fäkal-oralem Wege übertragenen Erregern der Hepatitis A (HAV) und Hepatitis E (HEV), die in der Regel keine Chronifizierung verursachen, kommt es bei Infektion mit dem parenteral übertragenen HBV (DNA-Virus) in 5 - 10 % und dem HCV (RNA-Virus) in bis zu 75 % zu chronischen Verläufen. Wie später dargestellt, kann es nach neuesten Erkenntnissen auch bei der Hepatitis E zu chronischen Verläufen kommen [20]. Die Hepatitis D oder Delta-Hepatitis tritt immer in Verbindung mit der Hepatitis B auf und verläuft ebenfalls chronisch.
In Deutschland gelten nach Schätzungen 500 000 - 600 000 Menschen als mit dem HBV und bis zu 800 000 als mit dem HCV infiziert, wobei nur etwa die Hälfte der Erkrankungen diagnostiziert ist [3, 5]. Die Dunkelziffer nicht erkannter chronischer Virushepatitiden ist sehr hoch. Gerade diese bisher nicht diagnostizierten Infizierten stellen ein großes Gefahrenpotenzial für die weitere Ausbreitung der Erkrankungen und ihrer Folgen dar. Zudem kommt es bei 15 - 30 % der Patienten mit chronischer Infektion nach 20 bis 30 Jahren zu einer Leberzirrhose. Von diesen Patienten entwickeln 2 - 6 % ein HCC [10]. Die weltweite Zunahme des HCC in den letzten 30 Jahren (5. Stelle der maligen Tumoren) ist vor allem auf die Zunahme dieser chronischen Virusinfektionen zurückzuführen [7, 16].
Erhöhte Leberwerte immer abklären
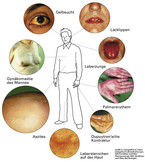
Subjektive Beschwerden, die an eine Lebererkrankung denken lassen sollten, sind in Übersicht 1 dargestellt. Übersicht 2 zeigt typische Leberhautzeichen. In der Praxis des Hausarztes sind erhöhte Leberwerte ein häufiger Befund, der oft auch im Rahmen eines Routine-Check-ups erhoben wird. Auch wenn eine Erklärung dafür (Alkoholkonsum, Schmerz- oder Rheumamittel, Fehlernährung) auf der Hand zu liegen scheint, muss immer auch eine Hepatitis ausgeschlossen werden. Bei länger erhöhten Transaminasen genügt in der Regel die Untersuchung auf Hepatitis B und C. Bei jüngeren, nicht Hepatitis-geimpften Patienten muss auch eine Hepatitis A in Betracht gezogen werden. Dies ist mit einfachen und verlässlichen Tests, die neben den Routineleberwerten ASAT, ALAT, GGT und AP sogenannte serologische Marker umfassen (vgl. Tabelle 1), möglich. Das Laborbudget des Hausarztes wird durch diese Basisdiagnostik nicht belastet, sofern er die entsprechende Befreiungsziffer 32006 bzw. 32005 bei Kontrolle im Rahmen einer antiviralen Therapie auf dem Laborüberweisungsschein und bei der KV-Abrechnung vermerkt.
Was ist bei der Interpretation der Virusmarker zu beachten?
Hepatitis A
Der Nachweis eines Anti-HAV-IgM-AK ist immer ein Hinweis auf eine akute Hepatitis A. Er ist bereits vor dem Beginn von Symptomen im Blut nachweisbar und fällt innerhalb von sechs Monaten unter die Nachweisbarkeitsgrenze.
Der Gesamt-Anti-HAV (IgG+IgM )-AK ist zum Zeitpunkt der klinischen Manifestation und darüber hinaus nachweisbar. Er ist ein zuverlässiger Marker für eine evtl. bestehende Immunität gegen HAV nach durchgemachter Erkrankung bzw. Impfung. Im Gegensatz zur unten dargestellten Hepatitis-B-Impfung ist bei der Hepatitis A nach Impfung keine Kontrolle dieses AK nötig.
Bei Männern mit protrahiertem Verlauf und verzögertem Abfall der Transaminasen ist nach eigener Erfahrung auch an die Möglichkeit einer Koinfektion mit HIV zu denken. Dies wird durch eine retrospektive Analyse aus den Jahren 2002 - 2008 im mittleren Italien [9] eindeutig bestätigt. Die Autoren fanden dabei eine hohe HIV-Prävalenz von 15,2 % bei männlichen Patienten im Alter zwischen 25 und 64 Jahren mit einer akuten HAV-Infektion. Diese Koinzidenz war signifikant höher als bei der Hepatitis B (4 %). Es sollte also bei jedem neuen Verdacht auf eine Hepatitis, besonders aber bei Hepatitis A, auch ein HIV-Test durchgeführt werden.
HAV-RNA ist im Serum und Stuhl mit Hilfe einer PCR nachweisbar. Sie ist zur Sicherung der Diagnose nicht nötig, aber hilfreich bei der Klärung der Infektiosität.
Hepatitis B
Die HBsAg-Bestimmung ist der wichtigste Screeningtest auf eine Hepatitis B. HBsAg zeigt eine aktive HBV-Infektion an. Seine quantitative Messung gewinnt zunehmend Bedeutung in der Steuerung der antiviralen Therapie [17].
Anti-HBs ist der AK zum HBsAg und der Marker für die Ausheilung und Immunität einer Hepatitis B.
Anti-HBc-Gesamt-AK (IgG + IgM) zeigt an, ob Kontakt mit HBV besteht oder bestand.
Anti-HBc-IgM ist positiv bei akuter HBV-Infektion oder bei einem akuten Schub einer chronischen Infektion.
HBeAg ist ein Marker für die Virusreplikation. Je nach Stärke der Ag-Exprimierung werden HBeAg-positive bzw. -negative Formen unterschieden. Es korreliert mit der HBV-DNA.
Anti-HBe ist der AK gegen HBeAg. Die Serokonversion von HBeAg negativ zu Anti-HBe positiv führt zu einem niedrig replikativen Status.
HBV-DNA (Viruslast) ist ein Marker der Virusreplikation. Seine Höhe hat prognostische Bedeutung und ist sehr wichtig in der antiviralen Therapie.
HBV-Genotypen: Für den klinischen Alltag bisher nicht verfügbare Marker, die aber aufgrund ihrer territorialen Unterscheidung bedeutsam sind in der antiviralen Therapiefindung der chronischen HBV-Infektion.
Tücken der Serologie
Die Fülle unterschiedlicher Marker bei der Hepatitis B führt einerseits wiederholt zur Fehlinterpretation der Befunde, andererseits zu häufig unnötigen Bestimmungen. Der wichtigste Marker einer HBV-Infektion in der Praxis ist das HBsAg. Dieses allein sichert die Diagnose. Für die Differenzierung einer akuten von einer chronischen Verlaufsform und zur Beurteilung der Immunität sollte auch der Anti-HBc-Gesamt-AK bestimmt werden. Bei einem Zustand nach durchgemachter Hepatitis mit Immunität sind Anti-HBc-Gesamt-AK und Anti-HBs positiv. Bei einer Hepatitis-B-Impfung mit Immunität ist nur Anti-HBs positiv. Da bis zu 20 % der Geimpften nach einer Grundimmunisierung keinen effektiven Anti-HBs-Titer (nach STIKO > 100 IU/l) und damit keine Immunität aufweisen, ist 4 - 6 Wochen nach Beendigung der Grundimmunisierung eine Bestimmung des Anti-HBs-Titers erforderlich, ebenso nach späteren Auffrischungsimpfungen. Bei unzureichendem Anti-HBs-Titer können bis zu drei Wiederholungsimpfungen durchgeführt werden, evtl. auch mit einem speziellen, effektiveren, aber auch teureren Impfstoff.
HBV-Diagnostik vor Chemotherapie
Die Häufigkeit einer HBV-Reaktivierung unter Chemotherapie beträgt bei HBs-Ag-Trägern bis zu 50 %, nach Knochenmarktransplantationen sogar bis zu 80 %. Es kann zu fulminanten, teils letalen Verläufen kommen [18] und transarterielle Chemoembolisationen können ebenfalls eine HBV-Reaktivierung verursachen [12]. Alle Leitlinien empfehlen daher vor der Einleitung o. g. Maßnahmen, HBsAg und Anti-HBc zu bestimmen und ggf. eine antivirale Therapie einzuleiten [3].
Hepatitis C
Anti-HCV zeigt an, ob Kontakt mit dem HCV besteht oder jemals bestand.
Die HCV-RNA zeigt die Replikation des Virus an. Die quantitative Messung mit einem sensitiven Assay ist von entscheidender Bedeutung in der Steuerung der antiviralen Therapie.
HCV-Genotypen. Im Gegensatz zu den Genotypen bei der Hepatitis B sind diese Genotypen voll integriert in das antivirale Therapiemanagement.
Der Hausarzt sollte bei positiven Anti-HCV-Befunden auch einen qualitativen HCV-RNA-Test durchführen. Quantifizierung und Genotypisierung sind dagegen zunächst nicht nötig und können dem Spezialisten überlassen werden. Bei einer Reihe von Patienten wechseln sich im Laufe der Jahre positive und negative HCV-RNA-Befunde ab. Dies ist zum einen auf die Sensitivität der verwendeten Assays, zum anderen auf die außerordentliche Dynamik des HCV zurückzuführen. Es genügen in einzelnen Fällen Restvirusmengen im lymphatischen Gewebe, die unter bestimmten immunologischen Situationen zu einer verstärkten Replikation des Virus und zum Wiederauftreten einer signifikanten HCV-Virämie führen.
Nach eigenen langjährigen Erfahrungen sollten auch erfolgreich therapierte (sustained virologic response) Patienten mindestens einmal, besser zweimal im Jahr getestet werden. Dies ist auch zur Überwachung dieser vermeintlich „gesunden, geheilten Hepatitis-C-Patienten“ notwendig, da der molekulare Beginn für die Entstehung eines HCC bis zu 30 Jahre vor seinem klinischen Nachweis zurückliegen kann und HCC auch bei erfolgreich Therapierten auftreten können [6].
Hepatitis-D-HDV - Delta-Hepatitis
Das HDV ist für seine Replikation vom HBsAg abhängig, d. h. infektionsgefährdet sind ausschließlich HBs-Ag-Träger [4]. Die persistierende HDV-Infektion ist die schwerwiegendste chronische Virusinfektion der Leber. Die Prävalenzen variieren weltweit erheblich. In Europa findet sich die Delta-Hepatitis vor allem im Süden und im Osten. In Deutschland sind 5 - 10 % aller HBV-Patienten Anti-Delta-positiv, es sind überwiegend Migranten und Drogenabhängige betroffen [17]. Die deutschen Leitlinien empfehlen, dass jeder HBsAg-positive Patient mindestens einmal auf Anti-HDV getestet werden sollte [3].
Anti-Delta-IgM sind sowohl in der akuten als auch in der chronischen Phase der Infektion nachweisbar. Der Abfall des Anti-HDV-Titers ist ein früher Marker der Ausheilung.
HDV-RNA beweist eine aktive Replikation. Die Untersuchung auf eine HDV-Infektion erfolgt in der Regel vom Spezialisten.
Hepatitis E
Das Erscheinungsbild der Hepatitis E hat sich gewandelt. Nachdem diese Erkrankung lange Zeit als Tropenkrankheit ohne chronische Verlaufsform galt, zeigt sich in den letzten Jahren eine wachsende Bedeutung in den Industrieländern.
Auch in Deutschland werden in zunehmender Zahl autochthone, d. h. dort erworbene und chronische Verläufe beobachtet [14]. Dafür verantwortlich gemacht wird der Genuss von unzureichend gegartem Fleisch oder Innereien vom Schwein, besonders vom Wildschwein.
Anti-HEV-IgM zeigt eine akute Hepatitis-E-Infektion an.
Anti-HEV-IgG weist auf eine stattgehabte Hepatitis-E-Infektion hin.
HEV-RNA gibt Auskunft über die Replikation des HEV.
Die AK zeigen ähnlich der Hepatitis A eine aktuelle (IgM positiv) oder eine stattgehabte Infektion (IgG positiv) an. In Einzelfällen ist auch die Durchführung einer PCR-Untersuchung zur Frage der Replikation erforderlich. Bei unklaren Erhöhungen der Transaminasen, aber auch bei protrahierten Verläufen mit wechselnden Transaminaseaktivitäten sollte an eine Hepatitis E gedacht und die entsprechende Diagnostik eingeleitet werden.
Während bei gesunden Menschen eine HEV-Infektion in den meisten Fällen zu einer klinisch nicht auffälligen Serokonversion oder einer akuten, aber selbstlimitierenden Leberentzündung führt, kann es bei Schwangeren und Patienten mit einer chronischen Lebererkrankung zu einem fulminanten Leberversagen kommen [1, 14]. Zunehmende Bedeutung gewinnen chronische HEV-Infektionen auch in der Transplantationsmedizin [17]. Im Rahmen der Abklärung erhöhter Leberwerte sollte aus den genannten Gründen neben den Hepatitiden A, B, C auch auf die Hepatitis E getestet werden.

Erschienen in: Der Allgemeinarzt, 2012; 34 (11) Seite 12-16